
�о������к�����ͺ�̼�������ת���Ի�������������Ҫ���塣
(1)SO2�Ĵ����ŷŻ��������صĻ��������� ����ʪ�����£�д��������SO2ת��ΪHSO3-�ķ���ʽ ��
(2)�����е�����ɽ�������H2S��������Ӧ������SO42-��������Ӧ�������仯ʾ��ͼ���£�
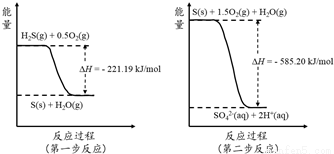
1mol H2S(g)ȫ��������SO42-(aq)���Ȼ�ѧ����ʽΪ ��
(3)SO2�ǹ�ҵ�������ԭ��֮һ��һ���¶��£����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ��2SO2(g)+O2(g) 2SO3(g)�������вⶨ�IJ������ݼ��±���
2SO3(g)�������вⶨ�IJ������ݼ��±���
ʱ��/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
�ٷ�Ӧ��0-4min�ڵ�ƽ������Ϊv(SO2)= ��
�ڴ��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ��
��8minʱ��ά���¶Ȳ��䣬��Ӧ��������ͨ��0.02mol SO2(g)��0.01mol O2(g)�����´ﵽƽ��ʱ���������SO2�İٷֺ����� (���С�����������䡱)��
(4)��ѧ���õ����ز�����ͭ��װ����ͼ���˹����ϵͳ�����ø�װ�óɹ���ʵ������CO2��H2O�ϳ�CH4�ķ�Ӧ��

д��ͭ�缫����ĵ缫��Ӧʽ ��Ϊ��߸��˹����ϵͳ�Ĺ���Ч�ʣ�����װ���м������� (����ᡱ�����ᡱ)��
 һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����
A��������Һ B������ C���Ȼ�����Һ D��Fe (OH)3 ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ����������������и�һ����ĩ��ѧ���������棩 ���ͣ�ѡ����
ͭ�۷���ϡ������Һ�У����Ⱥ������Ա仯������������ij���κ�ͭ�����ܽ⣬��������( )
A��NaCl B��KNO3 C��K2SO4 D��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�������¿��廯ѧ�Ծ��������棩 ���ͣ�ʵ����
�Ȼ��������ж��е���ɫ������������Ⱦ�ϡ�Ⱦ���м��塢ӡȾ����ֽ��ҵ����ˮ������ij����С��������·����Ʊ��Ȼ�������̽���Ȼ�������Fe2+���Ļ�ԭ�ԡ�
ijͬѧѡ������װ�����Ȼ����Ʊ������Ȼ�������װ�ò������ظ�ʹ�ã���
��������֪���Ȼ�����ˮ����ˮ�⣬�ڼ���������������ԭ�Ȼ�������FeCl2��HCl��
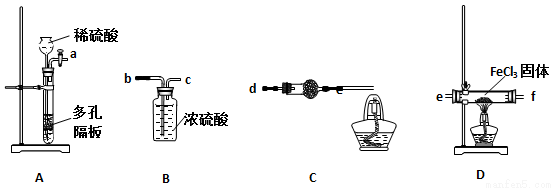
��1��ʵ�鿪ʼǰӦ�ȼ��װ�õ������ԣ�������װ��A�����Լ���ķ����� ��
��2�������������ң�װ�ýӿ�����˳���ǣ�
a�� �� ������ ������ ������ ������ ��
��3��װ��C�и��������ʢ�Լ�Ϊ��ʯ�ң��������ǣ� ��
�����������Ƶõ��Ȼ������п��ܺ����Ȼ�����ijͬѧ���������ʵ�飬�ⶨ��Ʒ����Ԫ�ص���������x���밴Ҫ��ش��������⣺
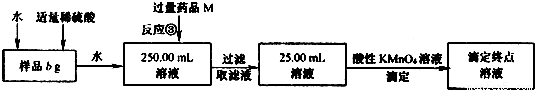
(4)��Ӧ�۵����ӷ���ʽΪ__ ___��
(5)��3��ƽ�еζ�ʵ�飬ƽ������c mol/L KMnO4��Һ�����Ϊd mL������Ʒ����Ԫ�ص���������(�������ʽ)x=_____________������Ʒ�ܽ���ʹ�������������ϡ���ᣬ��������Ʒ����Ԫ�ص�����������(�ƫ����ƫС������Ӱ�족)____ _________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�������¿��廯ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��X��Y��Z��W��ԭ�����������������Ƿֱ�λ�ڲ�ͬ�����塣X���������������۴�����Ϊ0��YΪ����Ԫ�أ�Y��Z����������֮����W��������������ȣ�X��W����������֮�͵���10������˵����ȷ���ǣ� ��
A. ԭ�Ӱ뾶��С˳��r��W��>r��Z��>r��Y��>r��X��
B. �е㣺XW2>Y2W
C. ����������Ӧ��ˮ��������ԣ�X<Z
D. ���⻯������ȶ��ԣ�Z>W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ�������¿�����ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ�������й�˵����ȷ����( )
A����1L 0.1mol/L��Na2CO3��Һ�У�����������С��0.1NA
B����1 mol NH4NO3����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH4+��ĿΪNA
C����״���£�2.24L�״��к���C��H������ĿΪ0.3NA
D����1mol Cl2ͨ��ˮ�У�HClO��Cl����ClO��������֮��Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����������Ļ�ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧ�� ȤС���ͬѧ
ȤС���ͬѧ ��ʵ�������ú�����������ͭ�ķ����Ͻ�Ϊ��Ҫԭ����ȡ��������Һ������ͭ�������ˮ�Ȼ���,��ʵ����������ͼ��ʾ��
��ʵ�������ú�����������ͭ�ķ����Ͻ�Ϊ��Ҫԭ����ȡ��������Һ������ͭ�������ˮ�Ȼ���,��ʵ����������ͼ��ʾ��
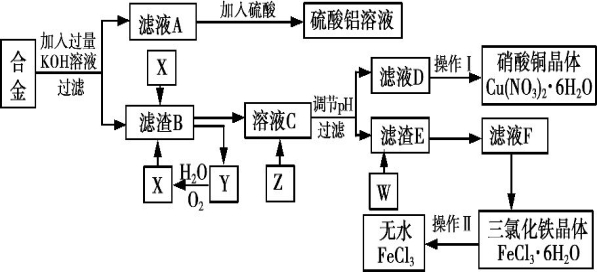
��֪:Fe3+������pH��ΧΪ1.9��3.2;Cu2+������pH��ΧΪ4.7 ��6.7��
��6.7��
��ش���������:
��1��д����Ͻ��м���KOH��Һ����������Ӧ�����ӷ���ʽ:__________________,���ڸ÷�Ӧ��ת��0.6NA�ĵ���,���ñ�״���µ��������Ϊ________L��
��2�����������п���Ϊ�Լ�Z����_______(�����)��
A��ͭ�� B����ˮ C������ͭ
����Z��,������Һ��pH��ΧӦΪ________________��
��3��ʵ��������˳������Ϊ____________(�����)��
A������Ũ�� B������ C����ȴ�ᾧ
��4��д������E��W��Ӧ�Ļ�ѧ����ʽ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����ģ���Ļ�ѧ���������棩 ���ͣ�ѡ����
�������в������������ý�����ȷ���ǣ�
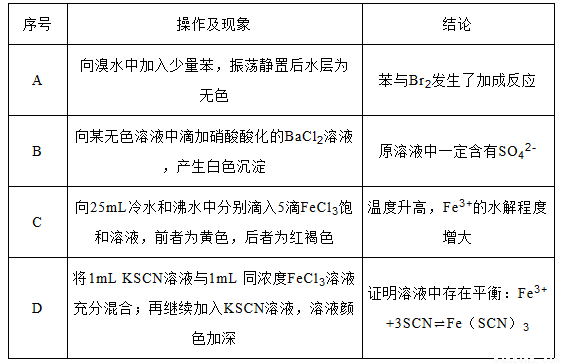
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ĸ������¿��廯ѧ�Ծ��������棩 ���ͣ�ѡ����
���úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO2(g)+3H2( g)?CH3OH(g)+H2O(g) ��H1=��58kJ��mol��
g)?CH3OH(g)+H2O(g) ��H1=��58kJ��mol�� 1��
1��
��CO(g)+2H2(g)?CH3OH(g) ��H2
��CO2(g)+H2(g)?CO(g)+H2O(g) ��H3,
��֪��Ӧ��һЩ������ʵĻ�ѧ�������������£�
��ѧ�� | C��O | C��H | H��H | H��O | C��O |
| 343 | 413 | 436 | 465 | 1076 |
���H2�͡�H3�ֱ�Ϊ
A��-99kJ��mol��1��+41kJ��mol��1
B��-99kJ��mol��1��-41kJ��mol��1
C��+99kJ��mol��1��-41kJ��mol��1
D��+99kJ��mol��1��+41kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com