
| A. | 该反应说明钠是强还原剂,可用于冶炼金属 | |
| B. | 该反应条件是TiCl4在熔融状态或水溶液中 | |
| C. | Ti是氧化产物 | |
| D. | TiCl4是还原剂 |
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 稀盐酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 把铜片放入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应与非氧化还原反应:反应前后元素化合价是否变化 | |
| B. | 纯净物与混合物:是否仅含有一种元素 | |
| C. | 强电解质与弱电解质:溶液的导电能力大小 | |
| D. | 溶液与胶体:能否发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )
X、Y、Z为中学化学常见物质,其转化关系如下图所示(“→”表示一步转化).下列组合不正确的是( )| 选项 | X | Y | Z |
| A | Al | Al(OH)3 | Al2O3 |
| B | Na | Na2O2 | NaOH |
| C | H2SO3 | SO2 | H2SO4 |
| D | HCl | Cl2 | HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
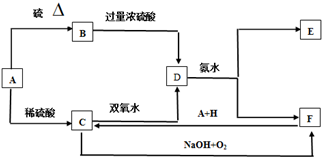
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )
为体现“绿色奥运”、“科技奥运”的理念,中国将在2008年北京奥运会时推出国产燃料电池汽车,作为马拉松领跑车和拍摄车,该车装有“绿色心脏”--质子交换膜燃料电池.下图是某科技杂志登载的该电池原理示意图.下列叙述正确的是( )| A. | 工作时,“阳极”周围溶液的酸性增强 | |
| B. | 氢气在电极上发生还原反应 | |
| C. | 图中标出的“阴极”实际是原电池的负极 | |
| D. | 工作过程中,质子(H+)从“阴极”一边透过质子交换膜移动到“阳极”一边与OH-反应生成水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com