
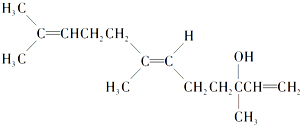
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇在氧气中充分燃烧,需消耗448 L氧气(标准状况) | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗3mol溴 |
分析 该有机物含有碳碳双键,可发生加成、加聚、氧化反应,含有羟基,可发生氧化、消去和取代反应,以此解答该题.
解答 解:A.该有机物含有羟基,可发生取代反应,含有碳碳双键,可发生加成反应,故A正确;
B.在浓硫酸催化下加热脱水,发生消去反应,能生成2种四烯烃,故B错误;
C.分子式为C15H26O,1 mol橙花醇在氧气中充分燃烧,需消耗氧气(15+$\frac{26}{4}$-$\frac{1}{2}$)mol=21mol,体积为21mol×22.4mol/L=470.4 L,故C错误;
D.有机物中含有3个碳碳双键,则1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗3mol溴,故D正确.
故选BC.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于有机物知识的综合应用,题目难度中等,易错点为D,注意把握有机物的结构特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、I-、CO32-、ClO- | B. | Ba2+、Na+、SCN-、Cl- | ||
| C. | Fe2+、H+、K+、NO3- | D. | Cu2+、Mg2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源物质 | |
| B. | 海水提溴、海带提碘的过程均不涉及化学变化 | |
| C. | 铝热反应放出大量的热,金属铝做还原剂 | |
| D. | 通过催化重整,可从石油中获取环状烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
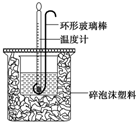 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 指示剂 | 变色范围 | 酸色 | 碱色 |
| 石蕊 | 5.0-8.0 | 红色 | 蓝色 |
| 酚酞 | 8.0-10.0 | 无色 | 红色 |
| 甲基橙 | 3.1-4.4 | 红色 | 黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com