
(2013?深圳一模)CH
4(g)+2NO
2(g)?N
2(g)+CO
2(g)+2H
2O(g);△H=-867kJ?mol
-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH
4和a molNO
2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 |
温度 |
|
0 |
10 |
20 |
40 |
50 |
| 1 |
130℃ |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
| 2 |
180℃ |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
|
0.15 |
(1)开展实验1和实验2的目的是
研究温度对该化学平衡的影响
研究温度对该化学平衡的影响
.
(2)180℃时,反应到40min,体系
是
是
(填“是”或“否”)达到平衡状态,理由是
温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态
温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态.可确定40min时反应已经达平衡状态
;CH
4的平衡转化率为
70%
70%
.
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值.(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO
2)的关系如图所示,请在图象中画出180℃时,压强为P
2(设压强P
2>P
1)的变化曲线,并做必要的标注.
(5)根据已知求算:△H2=
-1160KJ/mol
-1160KJ/mol
.
CH
4(g)+4NO
2(g)?4NO(g)+CO
2(g)+2H
2O(g);△H1=-574kJ?mol
-1CH
4(g)+4NO(g?2N
2(g)+CO
2(g)+2H
2O(g);△H2.

 (2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
(2013?深圳一模)CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1.该反应可用于消除氮氧化物的污染.在130℃和180℃时,分别将0.50molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表: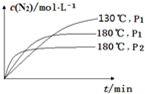 ,故答案为:
,故答案为: ;
;

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案