
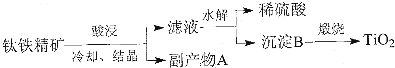
分析 钛铁精矿(FeTiO3)中加入稀硫酸,冷却、结晶、经充分反应后过滤,所得滤液中含有Ti4+、Fe2+、Fe3+等离子,滤渣为硫酸亚铁晶体,Ti4+水解生成H2TiO3和稀硫酸,过滤,得到沉淀B为H2TiO3,煅烧H2TiO3得到TiO2产品,
(1)FeTiO3与氢离子反应生成Fe2+、Ti4+、H2O;提高浸出率可从浓度、温度等影响化学反应速率的角度解答;
(2)根据流程分析可知副产物A为 FeSO4•7H2O,注意防止水解;
(3)加水稀释、加热均能促进TiO2+水解;
(4)根据流程可知稀硫酸循环使用;
(5)高温下,TiO2和碳粉、氯气反应生成TiCl4和CO;在高温下用金属镁还原TiCl4得到金属钛和氯化镁.
解答 解:钛铁精矿(FeTiO3)中加入稀硫酸,冷却、结晶、经充分反应后过滤,所得滤液中含有TiO2+、Fe2+、Fe3+等离子,滤渣为硫酸亚铁晶体,TiO2+水解生成H2TiO3和稀硫酸,过滤,得到沉淀B为H2TiO3,煅烧H2TiO3得到TiO2产品,
(1)FeTiO3与氢离子反应生成Fe2+、Ti4+、H2O,其反应的离子方程式为FeTiO3+6H+=Fe2++Ti4++3H2O,提高浸出率,可增大硫酸浓度、升高温度、边加硫酸边搅拦、增加浸出时间等,
故答案为:FeTiO3+6H+=Fe2++Ti4++3H2O;增大硫酸浓度/升高温度/边加硫酸边搅拦/增加浸出时间等;
(2)由流程分析可知副产物A为 FeSO4•7H2O,因亚铁离子易水解,且水解呈酸性,为防止水解,应保持较大的酸度,
故答案为:FeSO4•7H2O;防止Ti(SO4)2水解、减少FeSO4•7H2O的溶解量;
(3)加水稀释、加热均能促进Ti4+水解,所以滤液水解时往往需加大量水稀释同时加热,促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀,
故答案为:促进Ti4+水解趋于完全,得到更多的H2TiO3沉淀;
(4)由流程可知:解钛铁精矿需要加入稀硫酸,TiO2+水解时生成H2TiO3和稀硫酸,则稀硫酸可以循环使用,符合绿色化学理念,
故答案为:水解得到的稀硫酸可以循环使用;
(5)高温下,TiO2和碳粉、氯气反应生成TiCl4和CO,其反应的方程式为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;在高温下用金属镁还原TiCl4得到金属钛和氯化镁,其反应的方程式为:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2;
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl.
点评 本题考查了物质分离提纯的方法和流程分析判断,为高考常见题型,掌握物质性质和实验操作流程是解题关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.
X、Y、Z、E是中学化学的常见物质,其中X、Y、Z均含同一种元素,在一定条件下相互转化的关系如图所示(部分反映的条件和H2O已略去).若E为酸性气体,Z为发酵粉的主要成分之一,Y、Z能水解且溶液均呈碱性,则Z的俗称是小苏打,Z的一种工业上的重要制取方法是:在饱和氯化钠溶液中先通入NH3,再通入CO2.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3 | |
| B. | 原NaOH溶液的浓度是0.500mol/L,所得固体是Na2CO3和NaHCO3 | |
| C. | 原NaOH溶液的浓度是1.00mol/L,所得固体是Na2CO3和NaOH | |
| D. | 原NaOH溶液的浓度是0.90mol/L,所得固体是Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂.它易溶于水,难溶于酒精,受热、遇酸易分解.工业上可用硫化碱法制备,反应原理:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$ CH3CH═CH2↑+NaCl+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 乙醛溶液中加入新制碱性Cu(OH)2悬浊液并加热CH3CHO+2 Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com