
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的三种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1 |
分析 根据题意三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),即Mr(X)<Mr(Y)<Mr(Z),
A、根据m=nM=$\frac{N}{{N}_{A}}$来判断大小即可;
B、根据密度ρ=$\frac{M}{Vm}$来计算其相对大小;
C、气体的物质的量n=$\frac{V}{Vm}$,Vm和气体的状态有关;
D、根据同温同体积的气体物质的量之比等于压强之比来计算.
解答 解:根据题意三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),即Mr(X)<Mr(Y)<Mr(Z),
A、根据m=nM=$\frac{N}{{N}_{A}}$M,分子数目相等的三种气体,质量最大的是相对分子质量最大的Z,原子数目相等的三种气体,质量最大的无法判断,故A错误;
B、根据密度ρ=$\frac{M}{Vm}$,气体处在相同的条件下,则密度和相对分子质量成正比,三种气体密度最小的是X,故B正确;
C、气体的物质的量n=$\frac{V}{Vm}$,Vm和气体的状态有关,三种气体体积均为2.24 L,Vm不一定等于22.4L/mol,所以它们的物质的量不一定均为0.1mol,故C错误;
D、同温下,体积相同的两容器分别充2gY气体和1gZ气体,Mr(Y)=0.5Mr(Z),则二者的物质的量之比是4:1,同温同体积的气体物质的量之比等于压强之比,Y、Z气体所承受的压强比为4:1,故D错误.
故选B.
点评 本题涉及物质的量以及阿伏伽德罗常数的计算等有关知识,注意阿伏伽德罗定律的推论的使用是关键,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
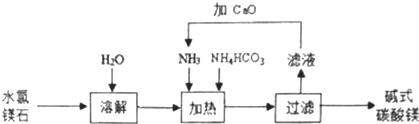
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
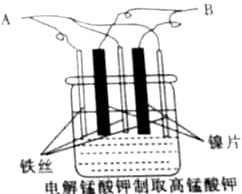 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向Fe(NO3)2样品溶于稀H2SO4 | 溶液不变红 | 稀硫酸不能氧化Fe2+ |
| C | 将SO2通入Ba(N03)2溶液中 | 无明显现象 | SO2与Ba(NO3)2不反应 |
| D | 葡萄糖溶液与新制Cu(OH)2混合加热 | 生成砖红色沉淀 | 葡萄糖分子中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似 | |
| B. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| C. | 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| D. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若容器内压强不再变化,则说明该反应己达平衡 | |
| B. | 反应前H2S物质的量为2.5mol | |
| C. | CO和H2S达平衡后的转化率相同 | |
| D. | 若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
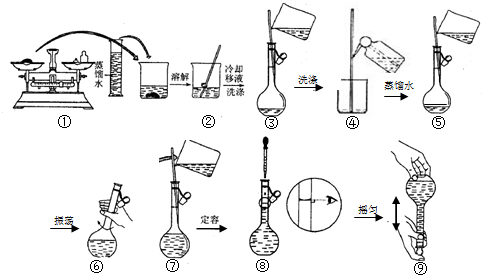
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com