
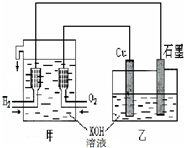
 利用图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O?Cu2O+H2↑.下列说法正确的是( )
利用图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O?Cu2O+H2↑.下列说法正确的是( )| A、乙中Cu电极的电极反应式是:2Cu+2OH-→Cu2O+H2O+2e- | B、甲中通入氢气的电极为正极 | C、乙中阴离子向石墨电极移动 | D、电路上通过0.5mol电子,可制得0.5mol Cu2O |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:阅读理解
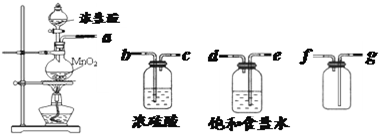
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液色 不褪色 |
固体物质中不含______ |
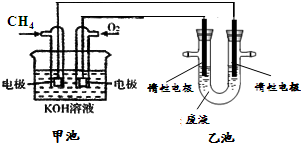
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
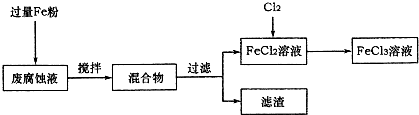
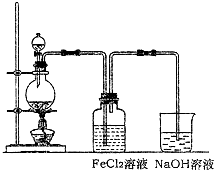
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
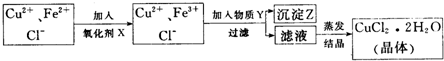
| 氢氧化物开始沉淀时的pH | 氯氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com