
分析 (1)基态Cr3+离子的电子排布式为1s22s22p63s23p63d3;基态25Mn2+离子的电子排布式为1s22s22p63s23p63d5;基态28Ni2+离子的电子排布式为1s22s22p63s23p63d8;
(2)Fe属于26号元素,Fe2+的核外有24个电子;因为3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构,能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+.
解答 解:(1)因为基态Cr3+离子的电子排布式为1s22s22p63s23p63d3,其3d轨道上有3个未成对电子,基态25Mn2+离子的电子排布式为1s22s22p63s23p63d5,其3d轨道上有5个未成对电子,基态28Ni2+离子的电子排布式为1s22s22p63s23p63d8,其3d轨道上有2个未成对电子,所以含未成对电子数最多的是25Mn2+离子,
故答案为:25Mn2+;
(2)Fe属于26号元素,Fe2+的核外有24个电子,则Fe2+的核外电子排布式为1s22s22p63s23p63d6;因为3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构,能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+,
故答案为:1s22s22p63s23p63d6或〔Ar〕3d6;3d轨道再失去一个电子后就成了半充满的结构,根据洪特规则,这种结构能量低,较稳定,所以,Fe2+容易失去一个电子,易被氧化为Fe3+.
点评 本题考查了离子的电子排布、洪特规则的应用,题目难度不大,注意注意基础知识的积累,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑、Cl2+H2O═HCl+HClO均为水作还原剂的氧化还原反应 | |
| C. | Cl元素的单质在化学反应中只表现氧化性 | |
| D. | NaSO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有还原性,可用于实验室制备氯气 | |
| B. | Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 | |
| C. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| D. | SO2具有漂白性,可用标准KMnO4溶液滴定食品中SO2残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Na+、Br-、Cu2+ | D. | Ca2+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
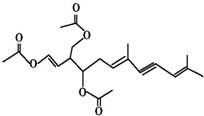 绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )| A. | 该物质的化学式为C21H26O6 | |
| B. | 该物质中含有两个手性碳原子 | |
| C. | 1 mol 该物质最多能消耗5 mol H2和3 mol NaOH | |
| D. | 该物质能发生加成反应、取代反应、氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com