
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O═Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO${\;}_{4}^{2-}$+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓ |
分析 A.澄清石灰水中氢氧化钙应拆成离子形式;
B.电荷不守恒;
C.电荷不守恒;
D.二者反应生成硫酸钡和氢氧化铜沉淀.
解答 解;A.澄清的石灰水与稀盐酸反应,离子方程式:OH-+H+═H2O,故A错误;
B.钠与水的反应,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.铜片插入硝酸银溶液中,离子方程式 Cu+2Ag+═Cu2++2Ag,故C错误;
D.CuSO4溶液与Ba(OH)2溶液混合,离子方程式Cu2++SO42-+2OH-+Ba2+═BaSO4↓+Cu(OH)2↓,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子方程式应遵循原子个数、电荷数守恒规律,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
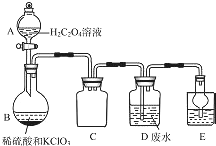 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
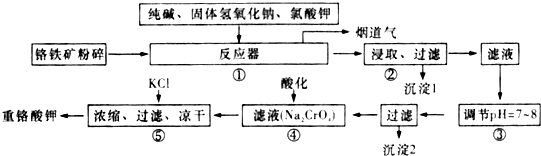
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Na2O+H2O═2NaOH | ||
| C. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ | D. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎把浓硫酸沾在手上,立即用干布拭去,再用水冲洗 | |
| B. | 少量金属钠应保存在煤油中 | |
| C. | 氢氟酸、浓硝酸、氯水存放在带橡皮塞的棕色玻璃瓶中 | |
| D. | 漂白粉应密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
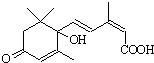 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,下列关于该物质的说法正确的是( )| A. | 其分子中含有3种官能团 | |
| B. | 能发生氧化反应,又能发生取代反应 | |
| C. | 可以与FeCl3溶液发生显色反应 | |
| D. | 1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
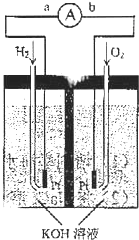 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com