
离子键的强弱主要决定于离子的半径和离子电荷数。一般规律是:离子半径越小,离子电荷数越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺序是( )
| A.K2O、MgO、CaO | B.MgO、K2O、CaO |
| C.MgO、CaO、K2O | D.CaO、MgO、K2O |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
| A.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。 |
| B.HF、HCl、HBr、HI的熔点沸点依次升高。 |
| C.乙醇分子与水分子之间只存在范德华力。 |
| D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。则关于“暖冰”的判断正确的是
| A.“暖冰”中存在离子键 |
| B.“暖冰”中水分子的O-H键是非极性键 |
| C.“暖冰”的密度大,有导电性和导热性 |
| D.水凝固形成20℃时的“暖冰”所发生的变化是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知H2、O2、Cl2、N2分子中共价键的键能依次为436 kJ·mol-1、497 kJ·mol-1、243 kJ·mol-1、946 kJ·mol-1,
(1)下列叙述正确的是 ( )。
A.N—N键键能为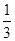 ×946=315.3kJ·mol-1 ×946=315.3kJ·mol-1 |
| B.氮分子中共价键的键长比氢分子中共价键的键长短 |
| C.氧分子中氧原子是以共价单键结合的 |
| D.氮分子比氯分子稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以下有关杂化轨道的说法中错误的是( )
| A.ⅠA族元素成键时不可能有杂化轨道 |
| B.杂化轨道既可能形成σ键,也可能形成π键 |
| C.孤对电子有可能参加杂化 |
| D.s轨道和p轨道杂化不可能有sp4出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知CO2、BF3、CH4、SO3都是非极性分子,NH3、H2S、H2O、SO2都是极性分子,由此可推知ABn型分子是非极性分子的经验规律是( )
| A.分子中所有原子在同一平面内 |
| B.分子中不含氢原子 |
| C.在ABn分子中,A元素为最高正价 |
| D.在ABn型分子中,A原子最外层电子都已成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述中正确的是( )
| A.干冰汽化时化学键发生断裂 |
| B.SiO2晶体有多种晶型,其基本结构单元是[SiO4]四面体结构 |
| C.Na2O和Na2O2所含化学键类型完全相同 |
| D.Br2蒸气被木炭吸附时共价键被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是( )。
| A.sp,范德华力 | B.sp2,范德华力 |
| C.sp2,氢键 | D.sp3,氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com