
【题目】对于反应2HI(g)![]() H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
H2(g)+I2(g,紫色),下列叙述能够说明已达平衡状态的是( )
A. 混合气体的质量不再变化
B. 温度和体积一定时,容器内压强不再变化
C. 1molH-H键断裂的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2∶1∶1
科目:高中化学 来源: 题型:
【题目】由一种短周期金属元素和一种非金属元素组成的化合物X可与水发生复分解反应。某校兴趣小组用如图装置(夹持装置略去)对其进行探究实验。
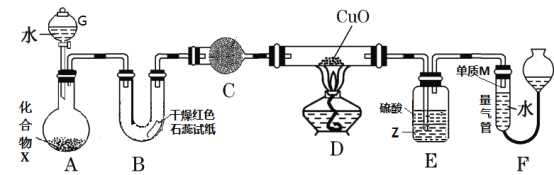
(1)仪器G的名称是_____________________,B中红色石蕊试纸变蓝,则单质M的电子式为___________________。
(2)化合物X中金属元素和非金属元素质量比为69:14,写出X与水反应的化学方程式:_________________________________。
(3)C中的试剂名称为___________________________。
(4)实验时,装置D中硬质玻璃管内的现象为_________________________。
(5)裝置E中试剂Z为___________(填化学式),装置E的作用是_________________。
(6)若不通过E、F两装置,请设计实验方案证明D中发生了反应(不通过观察D
中固体颜色发生变化)________________________________________ 。
(7)若装置A中固体样品含有杂质(杂质不参与反应),某同学通过测定F中单质M在标准状况下的体积和固体样品的质量,以确定固体样品中X的质量分数,判断该方案是否可行,并说明原因:_________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的元素符号是________(填写元素符号)。
(2)表中金属性最强的元素是____(填元素符号),该元素在周期表中的位置是_______。
(3)写出①、③、④最高价氧化物对应的水化物两两反应的化学方程式
_________________________________
_________________________________
_________________________________
(4)请设计一个实验方案,比较⑦、⑧非金属性的强弱(用化学方程式表示):_______。
(5)③、⑦两种元素形成的化合物的电子式为_____,⑦的气态氢化物的电子式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是
A.K2CO3和K2O都属于盐B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸D.Na2O和Na2SO3都属于氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用Ba(OH)2溶液吸收氯气:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B. Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C. NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D. 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:3,则Na2CO3和HCl溶液的浓度之比为( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置如图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100mL 0.206 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500mL溶液。量取25.00mL溶液于锥形瓶中,加入几滴酚酞试剂,并滴加0.05mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O 恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是____。
(2)用H2C2O4溶液滴定至终点时,溶液颜色变化是____。
(3)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3 为中学化学中经常使用的物质,长郡化学实验小组为探究 FeCl3 的性质,进行了如下实验。
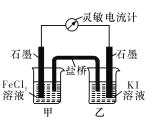
(1)学习小组 A 为探究 FeCl3与 KI 溶液的反应,特设计如右图所示的原电池实 验装置。在实验过程中,学习小组 A 发现,灵敏电流计的指针先偏转,最后 示数为零。若此时向甲中加入适量 FeCl2 固体,灵敏电流计的指针又发生偏转 此时________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为_________
(2)学习小组 B 把 FeCl3 溶液分别加入Na2CO3 溶液和Na2SO3溶液中,发现有如下实验现象:
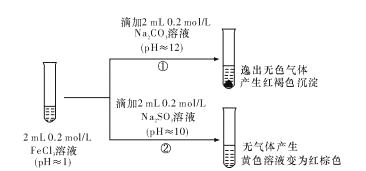
对于②中的实验现象,学习小组 B 的同学们有诸多猜测,继续进行实验: I.小明取②中的红棕色溶液少许,滴入盐酸酸化的 BaCl2溶液,产生白色沉淀。小明得出结论:FeCl3 与 Na2SO3 发生了氧化还原反应,离子方程式是_____。
Ⅱ,小红认为小明的实验不严谨,重新设计实验方案并进行实验,证实了小明的结论是正确的。其实验方 案是______________________________。
(3)学习小组 C 进一步探究 FeCl3 溶液与足量锌粉的反应。实验操作及实验现象如下表所示:

已知:Zn 的化学性质与 Al 相似,能发生反应![]()
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:______
②分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引
ii.向黑色固体中加入足量的 NaOH 溶液,产生气泡;
iii.将 ii 中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡; iv.向 iii 反应后的溶液中滴加 KSCN 溶液,无变化。 a.黑色固体中一定含有的物质是_____。
b.学习小组 C 认为上述实验无法确定黑色固体中是否含有 Fe3O4,理由是__________________
(4)为进一步探究 1.0 mol/L FeCl3 溶液中 Fe3+和 H+氧化性的相对强弱,学习小组 C 补充实验并观察到反应开始时的实验现象如下表所示:
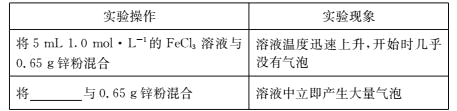
学习小组 C 得出结论:在 1.0 mol/L FeCl3 溶液中,Fe3+的氧化性比 H+强。则表格中横杠处应填____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com