
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
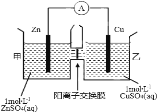
A.Zn电极上发生氧化反应
B.电子的流向为Zn→电流表→Cu
C.SO42-由乙池通过离子交换膜向甲池移动
D.电池工作一段时间后,乙池溶液的总质量明显增加
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列对元素周期表说法不正确的是( )
A. 在第ⅥB和第ⅦB族附近可以找到耐高温金属材料
B. 第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性
C. 如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置
D. 目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液,以下仪器中不需要用到的是( )
A. 烧瓶 B. 烧杯 C. 容量瓶 D. 玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池连接惰性电极电解一定量的CuSO4溶液,请回答下列问题:
(1)铅蓄电池放电时正极的电极反应式为________________________________;
(2)惰性电极电解CuSO4溶液的离子方程为_____________________;
(3)若电解一段时间后向电解池溶液中加入1molCu(OH)2·CuCO3,可以使该溶液恢复至原来的浓度和体积,则在该电解过程中转移电子的数目为___________,该电解过程中铅蓄电池中消耗的H2SO4和电解池中生成的H2SO4的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJmol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。

①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 金属元素的最外层电子数不一定小于4
B. 1A族元素形成的单质的熔点随原子序数的递增而降低
C. 同主族第三、第四周期的元素原子序数之差不一定等于18
D. 单质磷的化学性质比氮气活泼,容易与非金属等物质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式Ba2++SO42- ===BaSO4↓表示的是
A. 氯化钡和硫酸钠溶液反应 B. 碳酸钡和稀硫酸反应
C. 氢氧化钡和硫酸铝溶液反应 D. 氢氧化钡和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.0 kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol
2C(s)+2O2(g)=2CO2(g) △H=-787.0 kJ/mol
则尾气转化反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= 。
N2(g)+2CO2(g) △H= 。
(2)对于反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10-4 mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
c(CO)/×10-4 mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率 υ(CO2)= mol/(Ls)。
②在该温度下,反应的平衡常数K= 。
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是 。
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率, 提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4 mol/L和2.00×10-4 mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态

(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com