
对于反应 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

A. 两种不同的温度比较:T1>T2
B. A、C两点的反应速率:A〉C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法实现
D
【解析】
试题分析:A.反应为吸热反应,升高温度平衡正向移动,在压强为P1时,由B点到A点,NO2的体积分数增大,即T2>T1,故A错误;
B.由图象可知,A、C两点都在等温线上,C的压强大,则A、C两点的反应速率:A<C,故B错误;
C.由图象可知,在B、C两点时NO2的体积分数相等,气体的平均相对分子质量:B=C,故C错误;
D.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
故选D。
考点:体积百分含量随温度、压强变化曲线
点评:本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化。


科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 2CO(g),K1
CO(g)+H2O(g) H2(g)+CO2(g),K2
C(s)+H2O(g) CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g)2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g) 2N2(g) + 3H2O(g)
以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
查看答案和解析>>
科目:高中化学 来源:2012届上海市闵行区高三上学期期末质量抽测化学试卷 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 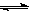 2CO(g),K1
2CO(g),K1
CO(g)+H2O(g) 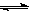 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g) 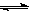 CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=a kJ·mol-1
②CO(g)+l/2O2(g)=CO2(g) ΔH=b kJ·mol-1
③C(石墨)+O2(g)=CO2(g) ΔH=c kJ·mol-1
则反应4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH= kJ·mol-1。
Ⅱ.依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是 (填序号)。
A.C(s)+CO2(g)=2CO(g) ΔH>0 B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
C.2H2O(l)=2H2(g)+O2(g) ΔH>0 D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH<0
若以稀硫酸为电解质溶液,则该原电池的正极反应式为 。
Ⅲ.氢气作为一种绿色能源,对于人类的生存与发展具有十分重要的意义。
(1)实验测得,在通常情况下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 。
(2)用氢气合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
①一定条件下,下列叙述可以说明该反应已达平衡状态的是 。
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
②下图表示合成氨反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的NH3的含量最高的一段时间是 。图中t3时改变的条件可能是 。

③温度为T℃时,将4a mol H2和2a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%,则反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市闵行区高三上学期期末质量抽测化学试卷 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g) 2NO2(g)-Q(Q>0),在温度
2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。

A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)

以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com