
【题目】下列分子或离子中键角由大到小排列顺序的是( )
①BCl3 ②NH3 ③H2O ④CH4 ⑤BeCl2
A. ⑤④①②③ B. ⑤①④②③ C. ④①②⑤③ D. ③②④①⑤
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各项中的X和Y两种原子,化学性质一定相似的是
A. X原子和Y原子最外层都只有一个电子
B. X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C. X原子的2p能级上有三个电子,Y原子的3p能级上有三个电子
D. X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机原料,根据以下合成路线,回答问题。
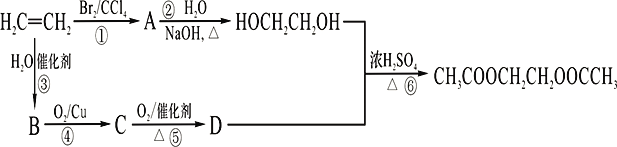
(1)写出乙烯的电子式_____________;A的名称为______________;
(2)B分子中的官能团名称是_________________;
(3)写出指定反应的反应类型:②________________,③______________;
(4)写出指定反应的化学方程式:④________________;⑥_____________。
(5)与B和D反应的生成物互为同分异构体,其中能和氢氧化钠反应的物质的结构简式_____________;
(6)HOCH2CH2OH能被酸性高锰酸钾氧化成E,写出E和HOCH2CH2OH生成高聚物的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物.下列判断错误的是( )
①MO2具有氧化性②白色不溶物X为MSO2③白色不溶物X为MSO4④白色不溶物X为MS.
A.①②
B.③④
C.②④
D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H+、Na+、Al3+、Ba2+、OH-、HC03一、Cl-七种离子形成了甲、乙、丙、丁四种化合物,它们之间可以发生如下转化关系(产物H20未标出),下列说法不正确的是

A.白色沉淀A可能能溶解在溶液D中
B.在甲中滴加丁可能发生反应:HC03一+Ba2+ +OH-= BaC03 +H20
C.溶液丙与I一、N03一、S042-可以大量共存
D.溶液甲中一定满足:c(H2C03)+c(H+)=c(OH-)+c(C032-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如下表,则M离子可能为( )
所含离子 | Cl﹣ | SO42﹣ | H+ | M |
浓度/(molL﹣1) | 2 | 1 | 2 | 1 |
A.Na+
B.Ba2+
C.NO3﹣
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用。________________________________
________________________________________________________________________。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO![]() 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:___________________________。
②每生成1 mol FeO![]() 转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题?___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com