
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
分析 相同温度下,溶液的酸性强弱是由氢离子浓度大小决定的,氢离子浓度越大,溶液的酸性越强,据此对各选项进行判断.
解答 解:A.0.01mol•L-1 H2SO4中c(H+)=0.01mol/L×2=0.02mol/L;
B.pH=2的H2SO4溶液中c(H+)=10-2 mol/L=0.01mol/L;
C.c(OH-)=10-13mol•L-1时,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-13}}$mol/L=0.1mol/L;
D.pH=1溶液加水稀释1倍,溶液的pH大于1,所以c(H+)<0.1mol/L;
根据分析可知,氢离子浓度最大的是C,
故选C.
点评 本题考查了溶液酸碱性强弱比较,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的表达式及计算方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸钙与盐酸反应:CO32-+2 H+=CO2↑+H2O | |
| B. | 铁粉投入到硫酸铜溶液中:Fe+Cu2+=Fe2++Cu | |
| C. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 钠和冷水反应 Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
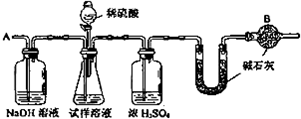
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,“氢化油”呈液态 | |
| B. | 纤维素和淀粉均属于“糖类,它们在人体内水解的最终产物均为葡萄糖 | |
| C. | 要鉴别石蜡油中是否混有少量苯,可加入四氯化碳,萃取,观察是否分层 | |
| D. | 用灼烧闻气味的方法来区别棉织物和毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
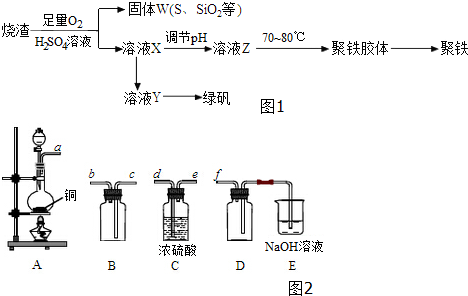
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com