
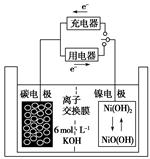
| A.放电时K+移向负极 |
| B.放电时电池负极的电极反应为:H2-2e-=2H+ |
| C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| D.该电池充电时将碳电极与电源的正极相连 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:不详 题型:单选题
A.
| B.
| C.14+
| D.14+
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 | ||||||||
| B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 | ||||||||
C.BaSO4和BaCO3共存的悬浊液中
| ||||||||
| D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是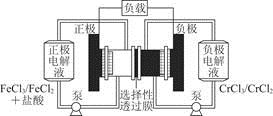
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.充电时阳极反应为Li++e-=Li |
| B.充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C.放电时电池内部Li+向负极移动 |
| D.放电时,在正极上是Li+得电子被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- = 4OH - |
| B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S)-2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq) |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
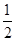 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1 [Cu(NH3)3]Ac·CO △H<0
[Cu(NH3)3]Ac·CO △H<0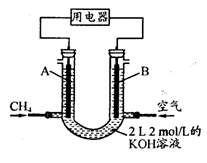
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
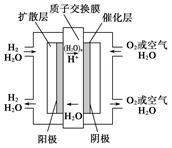
| A.通入氧气的电极发生氧化反应 |
| B.通入氢气的电极为正极 |
C.总反应式为O2+2H2 2H2O 2H2O |
| D.正极的电极反应式为O2+4H++4e-===2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.负极,被氧化 | B.负极,被还原 |
| C.正极,被还原 | D.正极,被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com