
【题目】向20mL某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
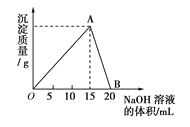
(1)图中A点表示的沉淀是_______,其物质的量是_________;
(2)图中B点溶液中的溶质有______________;
(3)所用AlCl3溶液的物质的量浓度是____________;
(4)当所得沉淀量为0.39g时,用去NaOH溶液的体积是______mL或______mL;
(5)O点到B点反应的总离子方程式为:__________________________。
【答案】(1)Al(OH)3、0.01mol(2)NaAlO2、NaCl
(3)0.5mol/L(4)7.5、17.5(5)Al3++4OH-=AlO2-+2H2O
【解析】
试题分析:(1)开始AlCl3与NaOH反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,NaOH量逐渐增多,Al(OH)3量逐渐增大,到A点时氢氧化钠将AlCl3恰好完全沉淀时,Al(OH)3沉淀达到最大量,此时消耗NaOH的物质的量为2mol/L×0.015L=0.03mol,则Al(OH)3的物质的量为0.03mol÷3=0.01mol;
(2)Al(OH)3沉淀达到最大量后,再加NaOH,发生Al(OH)3+OH-=AlO2-+2H2O,沉淀量又逐渐减少,到B点时Al(OH)3与NaOH恰好完全反应生成NaAlO2和NaCl,溶液中的溶质有NaAlO2和NaCl;
(3)根据铝原子守恒,则n(AlCl3)=n[Al(OH)3]=0.01mol,
故氯化铝的物质的量浓度=0.01mol÷0.02L=0.5mol/L;
(4)0.39 g Al(OH)3的物质的量=0.39g÷78g/mol=0.005mol.
当NaOH溶液不足时,生成0.39 g Al(OH)3所需NaOH的物质的量为0.005mol×3=0.015 mol,需要NaOH溶液的体积=0.015mol÷2mol/L=0.0075L=7.5mL;
当NaOH溶液过量时,还剩余0.39 g Al(OH)3,剩余0.39 g Al(OH)3溶解可以消耗0.005molNaOH,故共消耗NaOH的物质的量=0.02L×2mol/L-0.005mol=0.035 mol,需要NaOH溶液的体积=0.035mol÷2mol/L=0.0175L=17.5mL;
(4)O点到B点表示Al3+与过量NaOH溶液作用生成NaAlO2,此反应的总离子方程式为Al3++4OH-=AlO2-+2H2O。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
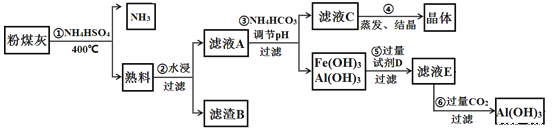
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,写出生成NH4Fe(SO4)2的化学方程式_____________。在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,写出反应的离子方程式:____________。
(2)滤渣B的主要成分为_____________。
(3) 已知Ksp[Fe(OH)3]=4×10-38,Ksp [Al(OH)3]=1×10-33。为实现步骤③的实验目的,应使溶液中c(Fe3+)、c(Al3+)均小于或等于1×10-9 molL﹣1可认为完全沉淀,则溶液A至少应调节到pH=_____________。用NH4HCO3调节pH的实验原理为_____________(用离子方程式表示)。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、__________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥缩聚反应 ⑦氧化反应 ⑧还原反应,其中可能在有机物分子中重新生成羟基的反应类型有
A. ①②③④ B. ⑤⑥⑦⑧ C. ①②⑦⑧ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X和Y中,X原子的最外层电子数是内层电子总数的一半,Y元素在该元素的前一周期,Y2﹣离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是( )
A.Z是一种酸酐
B.Z是一种碱性氧化物
C.Z的分子式一定是X2Y5
D.Z中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B分别与水反应都有气体放出,同时都生成C溶液,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,C与适量的F气体反应生成D,D溶液与F气体反应生成E,E加热能够生成D、F气体和水。根据以上叙述回答下列问题:
(1)写出下列物质的化学式:
A__________B__________,C__________,D_________
(2)按要求完成方程式:
①E加热生成D和F的化学方程式_______________________________;
②C溶液和CO2反应生成D的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金用途广泛,如新型储氢合金材料的研究和开发,将为氢气作为能源的实际应用起到重要的推动作用。下列材料中,不属于合金的是
A. 青铜 B. 黄铜 C. 陶瓷 D. 不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的
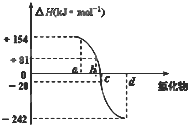
A.含有18e-的两种氢化物中只存在极性键
B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te
C.a所对应的氢化物是H2O
D.每1mol H2S分解会吸收20KJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的关系正确的是
A、V(碱)=102V(酸) B、V(碱)=2 V(酸)
C、V(酸)=102V(碱) D、V(酸)=2 V(碱)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com