
下列有关溶液的叙述错误的是
A. pH相同的①CH3COONa、②NaHCO3、③NaAlO2溶液中c(Na+):③>②>①
B. 将0.2mol·L-1NaHCO3溶液与0.1mol·L-1KOH溶液等体积混合:3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C. 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
D. 向AgCl和AgBr的等体积饱和溶液中加入足量AgNO3溶液,则AgCl沉淀多于AgBr沉淀
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
下列有关溶液中微粒浓度关系的叙述正确的是( )
A. 物质的量浓度相等的HCN和NaCN的混合液(pH>7) 中:c(Na+)>c(CN-)>c(HCN)>c(OH-)
B. 在pH=7的NH4Cl和NH3?H2O的混合溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 0.1mol?L-1的(NH4)2C2O4溶液中:c(NH4+)=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
D. 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:简答题
(1)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某温度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=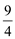 ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如下表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol·L-1 | 0.10 | 0.10 | 0.20 |
①10 min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=___________。
②丙达到平衡所用的时间_______10 min(填“<”、“>”、“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_______________。
(2)研究铁及其化合物对生产生活具有重要的意义。一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
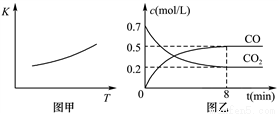
①反应ΔH__________0(填“<”或“>”)。
②下列措施中能使平衡时c(CO)/c(CO2)增大的是__________(填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
③一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。计算该反应的平衡常数K=_______。
(3)已知:CO(g)+2H2(g)=CH3OH (g) ΔH=-116 kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1;
H2 (g)+1/2O2(g)=H2O(g) ΔH=-242 kJ·mol-1 ;
写出CH3OH燃烧生成CO2和水蒸气的热化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
下列有关盐类水解的应用不正确的是
A. 明矾、氯化铁晶体可用于净水
B. 实验室通常可使用热的纯碱溶液去除油污
C. 实验室配制FeCl3溶液时可加入少量盐酸
D. 直接加热CuCl2溶液能得到CuCl2固体
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:推断题
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______(阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如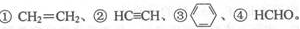 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
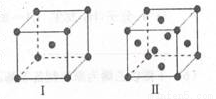
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(五)理综化学试卷(解析版) 题型:选择题
化学与资源、环境、生活关系密切相关,下列说法正确的是
A. 煤燃烧时加入少量生石灰的目的是减少废气中的二氧化碳排放
B. 空气中PM2.5(2.5微米以下的颗粒物)的存在可能形成丁达尔效应
C. 葡萄糖、蔗糖、油脂和蛋白质等营养物质在人体吸收后都能被水解
D. 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮、氧化变质
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:选择题
电解尿素[CO(NH2)2]的碱性溶掖可以制取氢气,其装置如下图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列有关说法中不正确的是
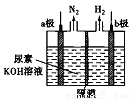
A. 电解过程中b极附近溶液碱性明显增强
B. 溶液中的OH-逐渐向a极区附近移动
C. 若在b极产生标准状况下224mL氢气,则消耗尿素2g
D. a极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
利用如图装置,完成很多电化学实验.下列有关此装置的叙述中,正确的是
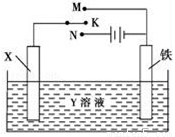
A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可加快铁的腐蚀
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,可用于铁表面镀铜,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源:2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷(解析版) 题型:选择题
用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图,a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨。甲~戊分别代表生产中的原料或产品,其中丙为硫酸溶液。下列说法错误的是
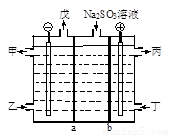
A. 图中a表示阳离子交换膜
B. 当电路中通过1mol电子的电量时,会有0.25mol的O2生成
C. 甲为NaOH溶液
D. 阳极的电极反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com