
����Ŀ�������Ѿ�ѧ��������������������̼��������������������������Ʊ������ͻ�ѧ����.������ʵ�����Ʊ���ϴ�ӡ��������弰����β�������ij�������װ��.������ѧ֪ʶ�ش��������⣺
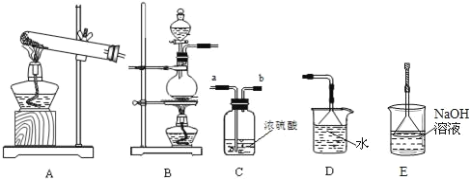
(1)����������,ֻ���ü�ʯ�Ҹ������ ______ (����ĸ)
A.H2B.Cl2C.SO2D.O2
(2)ʵ������ȡ������Ӧԭ�������ӷ���ʽ��______����ѡ�Ʊ�װ����______������������______��ֽ��β�����������ӷ���ʽΪ___________��
(3)ʵ�������Ȼ�狀���ʯ����ȡ����,�仯ѧ��Ӧ����ʽ____________����ҵ����������ʯ���鷴Ӧ�Ʊ�Ư�۵Ļ�ѧ����ʽΪ____________��
���𰸡�D MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2��+ 2H2O װ��B ����KI��ֽ Cl2+2OH-�TCl-+ClO-+H2O 2NH4Cl+Ca(OH)2
Mn2+ + Cl2��+ 2H2O װ��B ����KI��ֽ Cl2+2OH-�TCl-+ClO-+H2O 2NH4Cl+Ca(OH)2![]() 2 NH3��+2H2O +CaCl2 2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2 NH3��+2H2O +CaCl2 2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
��������
(1)���Ը����ֻ�ܸ���������壬�������������������壬���������������ܺͼӦ��
(2)ʵ�����ö������̺�Ũ�����ڼ��ȵ���������ȡ��������Ӧ���״̬�ǹ����Һ�壬��Ӧ�����Ǽ��ȣ�����ѡB���������������ԣ��������������õ���KI��ֽ�������ܺ�ˮ���ͼӦ������ˮ��Ӧ�ij̶Ȳ�����Ӧ�ij̶ȴ������ü�Һ����������
(3)ʵ�������Ȼ�狀��������Ƽ�����ȡ�������������а������Ȼ��ƺ�ˮ����ҵ����������ʯ���鷴Ӧ�Ʊ�Ư��ͬʱ����ˮ��
(1)���Ը����ֻ�ܸ���������壬�������������������壬���������������ܺͼӦ�����Բ����ü�ʯ�Ҹ���������������壬�������ü�ʯ�Ҹ����ѡD��
(2)ʵ�����ö������̺�Ũ�����ڼ��ȵ���������ȡ���������ӷ���ʽ�ǣ�MnO2 + 4H+ + 2Cl- ![]() Mn2+ + Cl2��+ 2H2O����Ӧ���״̬�ǹ����Һ�壬��Ӧ�����Ǽ��ȣ�����ѡB���������������ԣ��������������õ���KI��ֽ�������ǵ���KI��ֽ�����������ܺ�ˮ���ͼӦ������ˮ��Ӧ�ij̶Ȳ�����Ӧ�ij̶ȴ������ü�Һ�������������ӷ���ʽΪ��Cl2+2OH-�TCl-+ClO-+H2O���ʴ�Ϊ��B������KI��ֽ��Cl2+2OH-�TCl-+ClO-+H2O��
Mn2+ + Cl2��+ 2H2O����Ӧ���״̬�ǹ����Һ�壬��Ӧ�����Ǽ��ȣ�����ѡB���������������ԣ��������������õ���KI��ֽ�������ǵ���KI��ֽ�����������ܺ�ˮ���ͼӦ������ˮ��Ӧ�ij̶Ȳ�����Ӧ�ij̶ȴ������ü�Һ�������������ӷ���ʽΪ��Cl2+2OH-�TCl-+ClO-+H2O���ʴ�Ϊ��B������KI��ֽ��Cl2+2OH-�TCl-+ClO-+H2O��
(3)ʵ�������Ȼ�狀��������Ƽ�����ȡ�������������а������Ȼ��ƺ�ˮ�����Է�Ӧ����ʽΪ��2NH4Cl+Ca(OH)2![]() 2 NH3��+2H2O +CaCl2����ҵ����������ʯ���鷴Ӧ�Ʊ�Ư��ͬʱ����ˮ����ѧ����ʽΪ��2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
2 NH3��+2H2O +CaCl2����ҵ����������ʯ���鷴Ӧ�Ʊ�Ư��ͬʱ����ˮ����ѧ����ʽΪ��2Cl2+ 2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ�������ݻ���ͬ�������٢ڢ��н������·�Ӧ��3A(g)��B(g) ![]() 2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��
2C(g) ��H<0������ʼ�¶���ͬ���ֱ�������������ͨ��3 mol A��1 mol B����ﵽƽ��ʱ��������C���ʵ���������ɴ�С��˳��Ϊ�� ��
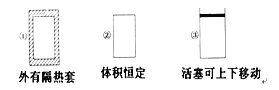
A. �ۢڢ�B. �ۢ٢�C. �٢ڢ�D. �ڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���AgNO3��Һ�ֱ�ζ�Ũ�Ⱦ�Ϊ0.01mol/L��KCl��K2C2O4��Һ�����õij����ܽ�ƽ��ͼ������ͼ��ʾ(������C2O42-��ˮ��)������������ȷ����
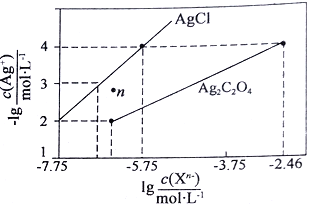
A.Ksp(Ag2C2O4)������������10-7
B.n���ʾAgCl�IJ�������Һ
C.��c(Cl-)=c(C2O42-)�Ļ��Һ�е���AgNO3��Һʱ��������Ag2C2O4 ����
D.Ag2C2O4+2C1-=2AgCl+C2O42-��ƽ�ⳣ��Ϊ109.04
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������ͨ��һ����Ӧֱ����ɵ���
A. Al(OH)3 �� Al2O3 B. Al2O3 �� Al(OH)3
C. Al �� AlO2- D. Al3+ �� Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A.������(������Ƥ)�Ʋ���������Բ���ʴ
B.CH3Cl(g)��Cl2(g)![]() CH2Cl2(l)��HCl(g)���Է����У���÷�Ӧ����H��0
CH2Cl2(l)��HCl(g)���Է����У���÷�Ӧ����H��0
C.MnS����Һ�еμ�����CuSO4��Һ������CuS��������Ksp(CuS)< Ksp(MnS)
D.�ϳɰ������н�NH3Һ�����룬һ���ܼӿ�����Ӧ���ʣ����H2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܼ��仯����㷺Ӧ���ڴ��Բ��ϡ���ز��ϼ���Ӳ���ϵ�����
��1��CoxNi(1-x)Fe2O4������Co��Ni��Ϊ+2��������H2O2�ֽ�Ĵ��������нϸߵĻ��ԡ�
�ٸô�������Ԫ�صĻ��ϼ�Ϊ______��
��ͼ1��ʾ���ֲ�ͬ�����ƵõĴ���CoxNi(1-x)Fe2O4��10��ʱ���ֽ�6%��H2O2��Һ����Գ�ʼ������x�仯���ߡ���ͼ����Ϣ��֪��______________����ȡ�õ��Ĵ������Ը��ߣ�Co2+��Ni2+���������д�Ч�����õ���______��
��2�����������Ʊ��ܵ����������Ҫԭ�ϡ���ͼ2Ϊ��ˮ�ϲ����ܣ�CoC2O4��2H2O���ڿ��������ȵ������仯���ߣ�������300�漰�������ù����Ϊ�������
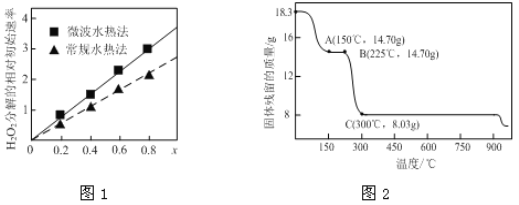
��ͨ������ȷ��A��ʣ�����Ļ�ѧ�ɷ�Ϊ________________���ѧʽ������д��B���Ӧ��������O2��225��~300�淢����Ӧ�Ļ�ѧ����ʽ��_________________________________________��
��ȡһ�������Ķ�ˮ�ϲ����ֽܷ��������������Co�Ļ��ϼ�Ϊ+2��+3������480 mL 5 mol/L����ǡ����ȫ�ܽ���壬�õ�CoCl2��Һ��4.48 L����״��������ɫ���塣��ȷ��������������Co��O�����ʵ���֮��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧʵ���г������Ʊ����岢����ijЩ���ʵļ��������ʵ���װ�ã�A���Ʊ������װ�ã�C��D��E��F��ʢװ��Һ�������ͬ��Ҳ���ܲ�ͬ���Իش�

��1�����A�еĹ���������̼����Һ©����ʢװ����Ũ���ᣬ��д�������Ļ�ѧ��Ӧ����ʽ��____����Ҫ�������ɵIJ����B��C��D��E��F��Ӧ�ֱ������Լ�Ϊ__��__��__��__��__��E���Լ���C����ͬ��E���Լ����������__��Bװ�ó��ɼ��ij�����⣬������__���á�
��2������������ʵ��ʱ��F�еõ�10.0 g���壬��A�з�����Ӧת�Ƶĵ�����Ϊ__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� B. ��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƣ�![]() ����һ�ֽⶾҩ�������軯��顢����Ǧ���顢����ж����ٴ�����������ݡ���Ƥ�������Ȳ�֢����������������Ի���Ի������ȶ�����������Һ�зֽ����
����һ�ֽⶾҩ�������軯��顢����Ǧ���顢����ж����ٴ�����������ݡ���Ƥ�������Ȳ�֢����������������Ի���Ի������ȶ�����������Һ�зֽ����![]() ��
��![]() ��
��
ʵ���.![]() ���Ʊ�����ҵ�Ͽ��÷�Ӧ��
���Ʊ�����ҵ�Ͽ��÷�Ӧ��![]() �Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ��
�Ƶã�ʵ����ģ��ù�ҵ���̵�װ����ͼ��ʾ��

(1)����a��������__________������b��������_____________��b��������������Ϊ70%~80%��![]() ��Һ��
��Һ��![]() ���巴Ӧ�Ʊ�
���巴Ӧ�Ʊ�![]() ��Ӧ�Ļ�ѧ����ʽΪ_______________________��c���Լ�Ϊ________��
��Ӧ�Ļ�ѧ����ʽΪ_______________________��c���Լ�Ϊ________��
(2)ʵ����Ҫ����![]() ���������ʣ����Բ�ȡ�Ĵ�ʩ��_________________________��д��һ������
���������ʣ����Բ�ȡ�Ĵ�ʩ��_________________________��д��һ������
(3)Ϊ�˱�֤��������ƵIJ�����ʵ����ͨ���![]() ���ܹ�����ԭ����_________________________��
���ܹ�����ԭ����_________________________��
ʵ���.̽��![]() ����������ӵ�������ԭ��Ӧ��
����������ӵ�������ԭ��Ӧ��
���ϣ�![]() ���Ϻ�ɫ��
���Ϻ�ɫ��
װ�� | �Լ�X | ʵ������ |
|
| ��Ϻ���Һ�ȱ���Ϻ�ɫ��30s����Һ������Ϊ��ɫ |
(4)��������ʵ���������ж�����![]() ��
��![]() ��ԭΪ
��ԭΪ![]() ��ͨ��________________________����������Լ���������һ��֤ʵ������
��ͨ��________________________����������Լ���������һ��֤ʵ������![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com