
| A. | 原子半径 P>S>Cl | |
| B. | 最高价氧化物对应水化物的酸性 H3PO4<H2SO4<HClO4 | |
| C. | 氢化物的稳定性 PH3<H2S<HCl | |
| D. | 元素的非金属性 P>S>Cl |
分析 A.同一周期元素,原子半径随着原子序数增大而减小;
B.元素非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素非金属性越强,其氢化物越稳定;
D.同一周期元素,元素非金属性随着原子序数增大而增强.
解答 解:A.同一周期元素,原子半径随着原子序数增大而减小,原子序数P<S<Cl,所以原子半径P>S>Cl,故A正确;
B.元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P<S<Cl,所以其最高价氧化物的水化物酸性 H3PO4<H2SO4<HClO4,故B正确;
C.元素非金属性越强,其氢化物越稳定,非金属性P<S<Cl,所以其氢化物的稳定性PH3<H2S<HCl,故C正确;
D.同一周期元素,元素非金属性随着原子序数增大而增强,原子序数P<S<Cl,所以非金属性P<S<Cl,故D错误;
故选D.
点评 本题考查元素周期律,为高频考点,侧重考查学生对元素周期律的综合应用,明确元素非金属性强弱判断方法是解本题关键,元素非金属性强弱与得电子难易程度有关,与得电子多少无关,题目难度不大.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③ | B. | ④ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
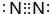 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ | |
| B. | 1 mol•L-1的NH4Cl溶液中含有NH4+的数目一定小于NA | |
| C. | NaHCO3溶液加水稀释,$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大 | |
| D. | 将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、ClO-、Cl- | B. | Mg2+、Na+、SO42-、Cl- | ||
| C. | Ca2+、HCO3-、NO3-、K+ | D. | Na+、Cu2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧是化学能转化为光能的过程 | |
| B. | 1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4 和 Ca(OH)2 反应中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 反应 H2(g)+F2(g)═2HF(g);△H=-270 kJ•mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com