
【题目】实验室配制物质的量浓度均为0.2mol/L 的NaCl溶液和稀H2SO4 各480mL.提供的试剂是:NaCl固体和98%的浓H2SO4(密度为1.84g/cm3)及蒸馏水.
(1)应用托盘天平称量NaClg,应用10mL量筒量取H2SO4mL;
(2)配制两种溶液时都需要的仪器是;
(3)稀释浓H2SO4时应注意;
(4)在配制上述溶液实验中,下列操作引起结果偏低的有(填序号)
A.在烧杯中溶解溶质搅拌时,溅出少量溶液
B.没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
C.定容时,加水超过了刻度线,倒出一些再重新加水到刻度线
D.将所配溶液从容量瓶转移到试剂瓶时,有少量溅出
E.把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
F.容量瓶刚用蒸馏水洗净,没有烘干
G.量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中.
H.容量瓶加水定容时俯视刻度线.
【答案】
(1)5.9;5.4
(2)烧杯、玻璃棒、500ml容量瓶、胶头滴管
(3)将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌
(4)ABCE
【解析】解:(1)配制480mL0.2mol/L 的NaCl溶液,应选择500mL容量瓶,需要溶质的质量m=0.2mol/L×58.5g/mol×0.5L=5.9g; 98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度c= ![]() =18.4mol/L,配制480mL0.2mol/L 的稀H2SO4 , 应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;所以答案是:5.9;5.4;(2)配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制两种溶液时都需要仪器:烧杯、玻璃棒、500ml容量瓶、胶头滴管;所以答案是:烧杯、玻璃棒、500ml容量瓶、胶头滴管;(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌.所以答案是:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;(4)A、在烧杯中溶解溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏低,溶液浓度偏低,故A选;B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏低,溶液浓度偏低,故B选;C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶质的物质的量偏低,溶液浓度偏低,故C选;D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,溶液浓度不变,故D不选;E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液稀释,溶液浓度降低,故E选;F、容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故F不选;G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,量取的浓硫酸物质的量偏大,溶液浓度偏高,故G不选;H、容量瓶加水定容时俯视刻度线,导致溶液的体积偏低,溶液浓度偏高,故H不选;故选:ABCE;
=18.4mol/L,配制480mL0.2mol/L 的稀H2SO4 , 应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,解得V=0.0054L,即5.4mL;所以答案是:5.9;5.4;(2)配制NaCl溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管;配制两种溶液时都需要仪器:烧杯、玻璃棒、500ml容量瓶、胶头滴管;所以答案是:烧杯、玻璃棒、500ml容量瓶、胶头滴管;(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌.所以答案是:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;(4)A、在烧杯中溶解溶质搅拌时,溅出少量溶液,导致溶质的物质的量偏低,溶液浓度偏低,故A选;B、没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏低,溶液浓度偏低,故B选;C、定容时,加水超过了刻度线,倒出一些再重新加水到刻度线,导致溶质的物质的量偏低,溶液浓度偏低,故C选;D、将所配溶液从容量瓶转移到试剂瓶时,有少量溅出,溶液浓度不变,故D不选;E、把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,溶液稀释,溶液浓度降低,故E选;F、容量瓶刚用蒸馏水洗净,没有烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故F不选;G、量筒量取浓H2SO4后没有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中,量取的浓硫酸物质的量偏大,溶液浓度偏高,故G不选;H、容量瓶加水定容时俯视刻度线,导致溶液的体积偏低,溶液浓度偏高,故H不选;故选:ABCE;


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列关于同分异构体数目的叙述不正确的是( )
A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C.含有5个碳原子的某饱和链烃,其一氯代物有3种
D.菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H﹣H键断裂时吸收热量为436kJ,求水蒸气中1mol H﹣O键形成时放出热量( )
A.463kJ
B.557kJ
C.486kJ
D.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,两个体积相等的容器,一个充满一氧化氮气体,另一个充满氮气和氧气的混合气体,这两个容器内一定具有相同的
A、原子总数 B、质子总数 C、电子总数 D、质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度(假设Zn2+浓度为10-5 mol·L-1时,Zn2+已沉淀完全)。下列说法不正确的是( )
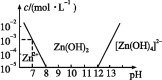
A.往ZnCl2溶液中加入足量氢氧化钠溶液,离子方程式为Zn2++4OH-![]() [Zn(OH)4]2-
[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+,沉淀Zn2+可以控制溶液pH的范围是8~12
D.向1 L 1 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( ) 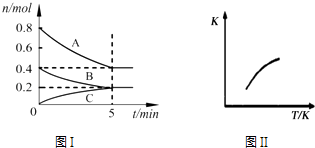
A.该反应可表示为:2A(g)+B(g)C(g)△H<0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述中正确的是( )
A. 金属钠可以保存在少量水中 B. 金属钠是银白色, 但露置于空气中会变暗
C. 钠在空气中燃烧生成白色的 Na2O D. 钠投入CuSO4溶液中可观察到有红色物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.化学反应中,某元素由化合态变成游离态,此元素可能被氧化,也可能被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com