
(8��)�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1�� ��ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO (g)��2H2(g) CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)����H2
CH3OH(g)��H2O(g)����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ�����________(���)��
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
�¶� | 250 �� | 300 �� | 350 �� |
K | 2��041 | 0��270 | 0��012 |
�ɱ��������жϣ���H1______0(�����������������)��
��ij�¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)��0��2 mol��L��1����CO��ת����Ϊ________����ʱ���¶�Ϊ________(���ϱ���ѡ��)��
��2�����и�������Ϊ�жϷ�Ӧ����2 L���ܱ������дﵽ��ѧƽ��״̬�����ݵ���_______���������ĸ����
A��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1
B��2v(H2)(��) �� v(CO)(��)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H1����1 275��6 kJ��mol��1
��2CO(g)��O2(g)===2CO2(g) ��H2����566��0 kJ��mol��1
��H2O(g)===H2O(l)����H3����44��0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��1���٢ڣ�����80%��250 �� ��2��C
��3��CH3OH(l)��O2(g)===CO(g)��2H2O(l) ��H����442��8 kJ��mol��
��������
�����������1�� �ٹ�ҵ��һ������������ַ�Ӧ�ϳɼ״�����Ӧ��CO (g)��2H2(g) CH3OH(g)��ԭ�ӵ�������Ϊ100%����Ӧ��CO2(g)��3H2(g)
CH3OH(g)��ԭ�ӵ�������Ϊ100%����Ӧ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)�и�����ˮ���ɣ����ϡ�ԭ�Ӿ��á�ԭ����Ǣڷ����������֪�������¶ȵ����ߣ���ѧƽ�ⳣ����С��ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����ʷ�Ӧ��Ϊ���ȷ�Ӧ����H1��0����ƽ��ʱһ����̼�����ʵ���=0.2mol/L��2L=0.4mol��ת����= n(CO)(��Ӧ)/ n(CO)(��ʼ)��100%=(2��0.4)mol/2mol��100%=80%��
CH3OH(g)��H2O(g)�и�����ˮ���ɣ����ϡ�ԭ�Ӿ��á�ԭ����Ǣڷ����������֪�������¶ȵ����ߣ���ѧƽ�ⳣ����С��ƽ�������ƶ��������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����ʷ�Ӧ��Ϊ���ȷ�Ӧ����H1��0����ƽ��ʱһ����̼�����ʵ���=0.2mol/L��2L=0.4mol��ת����= n(CO)(��Ӧ)/ n(CO)(��ʼ)��100%=(2��0.4)mol/2mol��100%=80%��
CO��g��+2H2��g�� CH3OH��g��
CH3OH��g��
��ʼŨ�ȣ�mol/L�� 1 3 0
ת��Ũ�ȣ�mol/L�� 0.8 1.6 0.8
ƽ��Ũ�ȣ�mol/L�� 0.2 1.4 0.8
ƽ�ⳣ��K=2.041��������250�棻��2��A��������CO��H2��CH3OH��Ũ��֮��Ϊ1��2��1����һ��Ϊ��ѧƽ��״̬������B��2v(H2)(��) �� v(CO)(��)������֮�Ȳ����ڻ�ѧ������֮�ȣ�����C�����ݰ����ӵ����ɣ�ͬ��ͬ����£������ѹǿ֮�ȵ������ʵ���֮�ȣ��÷�Ӧ����ӦΪ�������ʵ�����С�ķ�Ӧ��ѹǿ�淴Ӧ�Ľ��в��ϱ仯��������ѹǿ���ֲ��䣬˵����Ӧ�Ѵﻯѧƽ��״̬����ȷ��D�����������غ㶨��֪����������������Ӧǰ����ͬ������������㶨�������ܶȲ��淴Ӧ�Ľ��ж��仯���ܶȱ��ֲ��䲻����Ϊ��ѧƽ��ı�־������ѡC��
��3����֪����2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H1����1 275��6 kJ��mol��1
��2CO(g)��O2(g)===2CO2(g) ��H2����566��0 kJ��mol��1
��H2O(g)===H2O(l)����H3����44��0 kJ��mol��1�����ݸ�˹���ɣ��١�1/2���ڡ�1/2+�ۡ�2�ü״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH(l)��O2(g)===CO(g)��2H2O(l) ��H����442��8 kJ��mol��1��
���㣺���黯ѧƽ��״̬���жϣ�ƽ����㣬��˹���ɣ��Ȼ�ѧ����ʽ��д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�ӱ�ʡ�����еڶ�ѧ�����п��Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���У���ȷ���ǣ� ����
A��RCOOH��R��OH����������Ӧʱ����ROOCR��
B������NaOH��Һ��Ӧ������ʽΪC2H4O2���л���һ��������
C������������������������ụΪͬ���칹��
D����ȩ���������������ʽ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�ӱ�ʡ�����еڶ�ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��2L�ܱ������У����ֺ��£�����KClO3��MnO2����������ȡO2��5min������O232�ˣ���˷�Ӧ��ƽ�����ʿɱ�ʾΪ�� ��
A �� v(O2)��3��2g��L��1��min��1 B�� v(O2)��0��1 mol��L��1��min��1
C�� v(KCl)��0��1 mol��L��1��min��1 D�� v(KClO3)��0��0667 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡӥ̶�и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�ij���ÿ���������ұ�������ȼ���״��������һ����ҵ������ͼ��ʾ���������������Դ�����ʣ������˻�����Ⱦ��
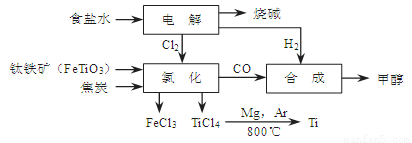
����д���пհף�
��1��д���������Ȼ��õ����Ȼ��ѵĻ�ѧ����ʽ�� ��
��2����CO��H2�ϳɼ״��Ƿ��ȵģ�����ʽ�ǣ�CO(g)��2H2(g)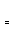 CH3OH(g)��
CH3OH(g)��
����֪�÷�Ӧ��300��ʱ�Ļ�ѧƽ�ⳣ��Ϊ0.27�����¶��½�2 mol CO��3 mol H2��2 mol CH3OH�����ݻ�Ϊ2 L���ܱ������У���ʱ��Ӧ�� ���������Ӧ������С��������淴Ӧ������С�����ƽ��״̬������
����ͼ��ʾ�ϳɼ״���Ӧ�ﵽƽ���ÿ��ֻ�ı��¶ȡ�ѹǿ�������е�ijһ��������Ӧ���ʦ���ʱ��t�Ĺ�ϵ�����б�ʾƽ�������еļ״��ĺ�����ߵ�һ��ʱ���� ��ͼ��t3ʱ�ı������������ ��
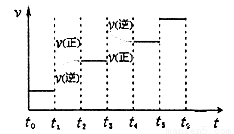
��3��ijͬѧ�����һ���״�ȼ�ϵ�أ����øõ�ص��200mL����Ũ��NaCl��CuSO4�����Һ����װ����ͼ��
��д������ͨ��״���һ���ĵ缫��Ӧʽ ��
������������������������������ʱ��仯�Ĺ�ϵ���ͼ��ʾ����������ѻ���ɱ�״���µ��������д����t1��,ʯī�缫�ϵĵ缫��Ӧʽ ��ԭ�����Һ��NaCl�����ʵ���Ũ��Ϊ mol/L����������Һ������䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡӥ̶�и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
A��D�Ǻ�ͬһԪ�ص��������ʣ������֮������ͼ��ʾ��ת����ϵ������A�ǵ��ʣ�D
�����������A�����ǣ� ��

��Al ��Mg ��Fe ��Na
A���٢� B���٢ڢ� C���٢� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡӥ̶����ѧ����ĩ�������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
˫��A��ΪʳƷ�����ϰ�װ����ƿ��������Ʒ�����Ӽ����ܵ��������ڷ���ʧ��,�Զ�ͯ�Ľ���Σ�����������й�˫��A����������ȷ���ǣ� ��
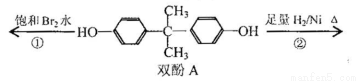
A��˫��A�ķ���ʽ��C15H16O2
B��˫��A�ĺ˴Ź���������ʾ��ԭ����֮����1:2:2:3
C����Ӧ���У�1mol˫��A�������2 mol Br2
D����Ӧ�ڵIJ�����ֻ��һ�ֹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡӥ̶����ѧ����ĩ�������߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ָ���������£����и��������ܴ���������ǣ� ����
A��ʹ���ȱ�����Һ�У�Fe2+��Na����I����NH4+
B��ǿ������Һ�У�K����Na����ClO����S2��
C��0��1 mol��L��1 NaAlO2��Һ�У�H����Na����Cl����SO42��
D����H2O�������c(H+)=10-11mol/L��Һ�У�Na����HCO3����AlO2����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡӥ̶����ѧ����ĩ��������һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��ɫ�Ļ��������ܺ�NO��CO2��NO2��NH3��N2�еļ��֣���100 mL�����徭����ͼʵ��Ĵ����� ����õ�������Һ��������������ʣ�࣬�����������Ϊ( )

A��NH3��NO2��N2 B��NH3��NO��CO2 C��NH3��NO2��CO2 D��NO��CO2��N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡЭ��������ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
(14��) ̼���仯�����й㷺����;��
��1��C(s)�� H2O(g)  CO(g) ��H2(g) ��H= +131.3 kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2�IJ��ʵ��� ��(�����)
CO(g) ��H2(g) ��H= +131.3 kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2�IJ��ʵ��� ��(�����)
A�������¶ȡ� B������̼������ C�������������D����CO���ռ���ȥCO
��2����֪��C��s��+ CO2��g�� 2CO��g�� ��H=+172.5kJ?mol-1
2CO��g�� ��H=+172.5kJ?mol-1
��CO��g��+H2O��g�� CO2��g��+H2��g���ġ�H=
CO2��g��+H2��g���ġ�H=
��3��CO��H2��һ�������¿ɷ�Ӧ���ɼ״����״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���ϡ�������������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ ��
��4����һ���¶��£���CO(g)��H2O(g)��0.16 mol�ֱ�ͨ�뵽���Ϊ2.0L�ĺ����ܱ������У��������·�Ӧ��CO(g)��H2O(g)  CO2(g)��H2(g)���õ��������ݣ�
CO2(g)��H2(g)���õ��������ݣ�
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)______v(��)(�>������<������=��)
�ڸ��¶��´˷�Ӧ��ƽ�ⳣ��K=___________
�������������䣬�ٳ���0.1mol CO��0.1mol H2O(g)��ƽ��ʱCO���������___________(���������С���������䡱)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com