
【题目】X、Y、Z、W是原子序数依次增大的短周期主族元素,且互不同族;其中X、Y为金属元素,Z、W为非金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。Y的单质可与NaOH溶液反应。
(1)Z的原子结构示意图为_________。
(2)Y、Z、W的原子半径由小到大的顺序是__________(用元素符号表示)。
(3)工业生产单质Y的原理是_________________(用化学方程式表示)。
(4)X与Y的化学性质相似,则单质X与NaOH浓溶液反应的化学方程式是_____________。
【答案】  C1<S<A1 2Al2O3
C1<S<A1 2Al2O3![]() 4Al+3O2↑ Be+2NaOH
4Al+3O2↑ Be+2NaOH![]() Na2BeO2 + H2↑
Na2BeO2 + H2↑
【解析】考查元素周期表和元素周期律的应用,X原子的最外层电子数与次外层电子数相等,则X为Be,X与W最外层电子数之和为9,则W的最外层电子数为7,因为X和Y都是金属元素,且五种元素原子序数依次增大,即W为Cl,Y的单质可与NaOH反应,因此Y为Al,Y和Z最外层电子数之和为9,则Z的最外层电子数为6,即Z为S, (1)S位于第三周期VIA族,第16号元素,原子结构示意图是 ;(2)同周期从左向右原子半径减小(稀有气体除外),因此是Cl<S<Al;(3)工业上冶炼铝,常采用电解熔融状态下的氧化铝,即化学反应方程式为:2Al2O3
;(2)同周期从左向右原子半径减小(稀有气体除外),因此是Cl<S<Al;(3)工业上冶炼铝,常采用电解熔融状态下的氧化铝,即化学反应方程式为:2Al2O3![]() 4Al+3O2↑;(4)Be和Al的性质相似,可以与氢氧化钠反应,反应方程式为:Be+2NaOH
4Al+3O2↑;(4)Be和Al的性质相似,可以与氢氧化钠反应,反应方程式为:Be+2NaOH![]() Na2BeO2+H2↑。
Na2BeO2+H2↑。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏如皋落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:
NiO(OH)+H2O+e-=Ni(OH)2+OH-
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组无色溶液中一定能大量共存的离子组是( )
A.酸性溶液中:Na+、HCO3-、OH-、K+
B.遇石蕊呈蓝色的溶液:MnO4-、Na+、Fe2+、Cl-
C.Ca2+、Ba2+、SO42-、NO3-
D.Ca2+、Mg2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:①Ba(OH)2 8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+ H2↑。试回答下列问题:
(1)两反应中属于吸热反应的是___________(填序号,下同〉,能设计成原电池的是_________。
(2)Fe-Cu原电池的装置如图所示。

①铁作______(填“正极”或“负极”),溶液中H+向______ (填“铁”或“铜”)电极方向移动。
②正极的现象是___________,负极的电极反应式为____________。
③若反应过程中有0. 2 mol电子发生转移,则生成的氢气在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )
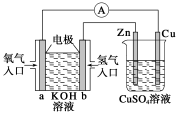
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏]2017年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是
A.夏天设定空调温度尽可能的低
B.推广使用一次性塑料袋和纸巾
C.少开私家车多乘公共交通工具
D.对商品进行豪华包装促进销售
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是( )

A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、SO42—
B.b点对应的溶液中大量存在:Na+、Fe3+、HCO3-、I-
C.c点对应的溶液中大量存在:Na+、Ca2+、Cl-、CO32—
D.d点对应的溶液中大量存在:Na+、K+、SO32—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用亚硝酸钠(NaNO2)作媒染剂、漂白剂、钢材缓蚀剂、金属热处理剂。某兴趣小组用下列装置制备NaNO2并探究NO、NO2的某一化学性质(A中加热装置已略去)。

已知:①2NO+Na2O2=2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+
请回答下列问题:
(1)装置A三颈烧瓶中发生反应的化学方程式为__________________。
(2)用上图中的装置制备NaNO2,其连接顺序为:a→_____________→h(按气流方向,用小写字母表示),此时活塞K1、K2如何操作_______________________。
(3)E装置发生反应的离子方程式是________________________。
(4)通过查阅资料,NO2或NO可能与溶液中Fe2+发生反应。某同学选择上述装置并按A→C→E顺序连接,E中装入FeSO4溶液,进行如下实验探究。

步骤②操作的目的是__________________;步骤③C瓶中发生的化学方程式为________________;
通过实验可以得出:___________(填“NO2、NO中的一种或两种”)和溶液中Fe2+发生反应使溶液呈深棕色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com