
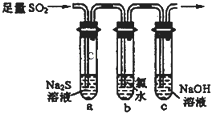
 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
| ||
| ||


科目:高中化学 来源: 题型:
| A、铝是地壳里含量最多的元素 |
| B、铝是热和电的良导体 |
| C、铝能溶解于冷的浓硝酸中,氧化生成硝酸铝 |
| D、铝硅合金的熔点比纯硅或铝的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
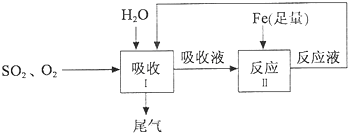
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(OH-)≤10-5mol?L-1 |
| c(OH-)≥10-4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
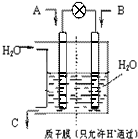 CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com