
| A. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO | B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | ||
| C. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | D. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{SO_{2}}{→}$HClO |
分析 A.氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁;
B.S燃烧只能生成二氧化硫;
C.钠燃烧生成过氧化钠;
D.氯气与氢氧化钙反应生成氯化钙、次氯酸钙,次氯酸钙与少量二氧化硫发生反应可生成HClO.
解答 解:A.MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO,分别发生复分解反应、分解反应,均可实现,故A正确;
B.应为S$→_{点燃}^{O_{2}}$SO2$→_{催化剂}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4,故B错误;
C.应为Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{H_{2}O}{→}$NaOH,故C错误;
D.应为Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$\stackrel{少量SO_{2}}{→}$HClO,若足量二氧化硫不生成HClO,故D错误;
故选A.
点评 本题考查金属及化合物的性质,为高频考点,把握元素化合物性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意D中氧化还原反应判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 制备乙酸乙酯的实验中,承接酯的小试管中盛放了一定量的氢氧化钠溶液 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中 | |
| C. | 在酸性重铬酸钾溶液中加入少量乙醇,橙色溶液变红 | |
| D. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释、平衡①、②均向右移,溶液中c(HSO3-)、c(H)+均减小 | |
| B. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| C. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(${HSO}_{3}^{-}$)+c(OH-)+$\frac{1}{2}$c(${SO}_{3}^{2-}$) | |
| D. | 加入氨水至中性,则2c(Na+)=c(${SO}_{3}^{2-}$)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
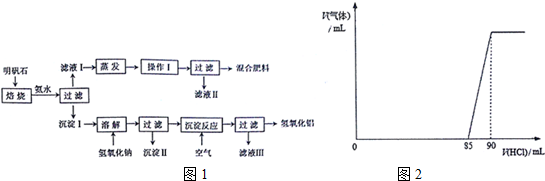
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
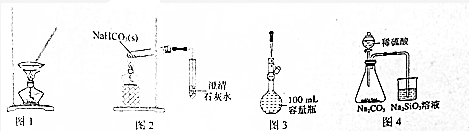
| A. | 用图1装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置来溶解、配置100mL•L-1NaCl溶液 | |
| D. | 用图4装置比较硫酸、碳酸、硅酸三种酸的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
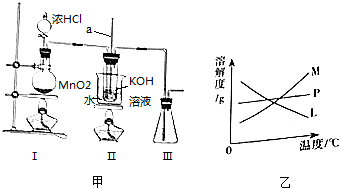
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
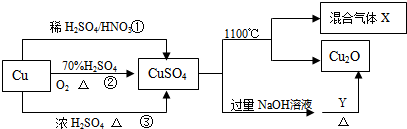
| A. | 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体 | |
| B. | 相对于途径①③,途径②更好地体现了绿色化学思想 | |
| C. | CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体 | |
| D. | Y可能是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数为0.2NA | |
| B. | 18gD2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5mol产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com