
【题目】下列说法错误的是
A. C2H6和C4H10一定是同系物
B. C2H4和C4H8一定都能使溴水退色
C. C3H6不只表示一种物质
D. 单烯烃各同系物中碳的质量分数相同
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】功能高分子材料(M)在生产、生活中有广泛用途,M的一种合成路线如下:
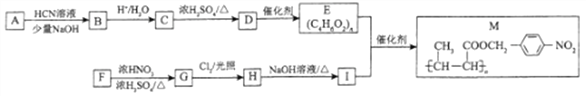
请回答下列问题:
(1)G的化学名称为____________。
(2)C中官能团的名称为____________。D的顺式结构简式为_________________。
(3)A→B的反应类型为____________。F分子中最多有____________个原子共平面。
(4)E+I→M的反应类型为__________;其反应的化学方程式为______________。
(5)同时满足下列条件的H的同分异构体有__________种。
① 苯环上连有—NH2
② 能与NaHCO3反应
(6)参照上述含成路线和信息,以乙醇为原料(无机试剂任选),设汁制备聚乳酸 的合成路线:__________________。
的合成路线:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验氯化氢气体中是否混有Cl2,可采用的方法是
A. 用干燥的蓝色石蕊试纸 B. 用干燥有色布条
C. 用湿润的淀粉碘化钾试纸 D. 将气体通入硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是
A. Na+、H+、MnO4-、CO32- B. NH4+、HCO3-、NO3-、Cl-、
C. Fe3+、NH4+、SCN-、SO42- D. Na+、ClO-、H+、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

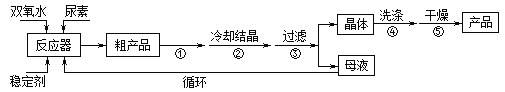
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题。
(1)在元素周期表中位于对角线的元素性质有相似性,如锂和镁。下列关于金属锂的说法不正确的是____。
A.金属锂是最轻的金属 B.锂可以和冷水反应放出氢气
C.碳酸锂易溶于水 D.氢氧化钠碱性强于氢氧化锂
(2)下列有关碱金属的说法中,正确的是_______。
A.金属锂应保存在煤油中
B.随着核电荷数增加,阳离子的氧化性逐渐减弱
C.它们都能在空气里燃烧生成M2O(M表示碱金属)
D.碱金属单质熔沸点随核电荷数的增大而升高
(3)金属锂是一种重要的储氢材料,吸氢和放氢反应原理如下:
吸氢反应:2Li+H2![]() 2LiH 放氢反应:LiH+H2O=LiOH+H2↑
2LiH 放氢反应:LiH+H2O=LiOH+H2↑
①放氢反应中的氧化剂是__________。
②己知LiH固体密度为0.8g/cm3。用锂吸收112L (标准状况)H2,生成的LiH体积与被吸收的H2体积比为_____。由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______mo1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A. 不能用磁铁将Fe与Fe3O4分离
B. 将生成的气体在空气中冷却可获得钠
C. 该反应条件下铁的氧化性比钠强
D. 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com