
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
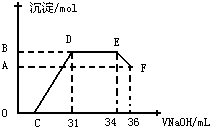
| 0.024mol×3 |
| 4mol/L |
| 0.008mol×3 |
| 4mol/L |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | A12O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ---- |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
- 2 |
- 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源:2012届山东省莱州一中高三第二次质量检测化学试卷 题型:填空题
(15分)Ⅰ某化学过程的示意图如图所示。在装置工作过程中,甲池的总反应式为: 。
。
试回答下列问题:
(1)甲池溶液中的 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极,
乙池溶液中的 移向 (填“ A”或“B”)电极;
移向 (填“ A”或“B”)电极;
(2)电极a上发生的电极反应式为 ; (3)乙池中发生反应的离子方程式为 ;
(3)乙池中发生反应的离子方程式为 ;
(4)当电极A处得到0.71g产物时,甲池中理论上消耗
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。
Ⅱ某研究性学习小组对铝热反应实验展开研究。现行高中化学教材对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知, 熔点、沸点数据如下:
熔点、沸点数据如下:
| 物质 | Al |  |  | 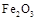 |
| 熔点/℃ | 660 | 2054 | 153 | 14 62 62 |
| 沸点/℃ | 2467 | 2980 | 2 750 750 | - |
 。
。 试剂中最适宜的试剂是
试剂中最适宜的试剂是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com