
| A.Ba(OH)2、Na2SO3、FeCl3、KCl |
| B.Na2SiO3、Na2CO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 |
| D.NaHCO3、C6H5COOH、C2H5OH、HCl |
科目:高中化学 来源:不详 题型:单选题
| A.①②③④ | B.③⑤⑥⑦⑧ | C.①③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 溶液中逐滴加入
溶液中逐滴加入 溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是
溶液20mL, 溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数(ω)变化如右图所示(CO2因逸出未画出),下列说法正确的是
A.在0.1mo1/L Na2CO3溶液中: |
| B.当溶液pH为7时,溶液的总体积为20mL |
| C.在B点所示的溶液中,阳离子浓度最大的是Na |
D.在 A点所示的溶液中: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ?OH-+H2S
?OH-+H2S
 ?H++S2-
?H++S2-查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此时水的离子积KW=1.0×10-14 | B.水电离出的c(H+)=1.0×10-10mol/L |
| C.水的电离度随温度升高而升高 | D.c(H3O+)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
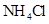 ②0.1mol/L
②0.1mol/L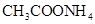 ③0.1mol/L
③0.1mol/L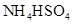
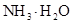 和0.1mol/L
和0.1mol/L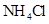 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L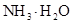
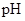 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)  的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。 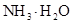 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 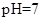 ,则说明
,则说明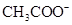 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" )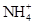 的水解程度,
的水解程度,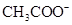 与
与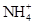 浓度的大小关系是:
浓度的大小关系是: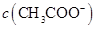
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com