
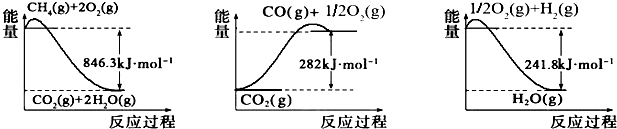
分析 (1)由图1、图2、图3可得热化学方程式:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
根据盖斯定律,①-②-③×3可得:CH4(g)+H2O(g)═CO(g)+3H2(g);
(2)正反应为放热反应,平衡常数增大,应降低温度,平衡正向移动;
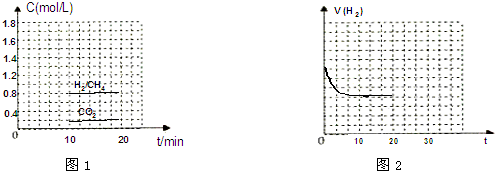
(3)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L):1.0 4.0 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
根据v=$\frac{△c}{△t}$计算v(CH4),根据n=cV计算氢气起始物质的量;代入K=$\frac{c(C{H}_{4})×{c}^{2}({H}_{2}O)}{c(C{O}_{2})×{c}^{4}({H}_{2})}$计算平衡常数;
②若现在20min时扩大容器体积,瞬间氢气浓度减小,反应速率减小,平衡逆向移动,逆反应速率减小的小到达到平衡状态.
解答 解:(1)由图1、图2、图3可得热化学方程式:
①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-846.3kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-282kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
根据盖斯定律,①-②-③×3可得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ•mol-1,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+161.1kJ•mol-1;
(2)反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H<0,故若使平衡常数K值变大,则平衡右移,必须通过降低温度才能实现.
A.平衡常数K值变大,平衡右移,故A正确;
B.平衡常数K值变大,平衡右移,须降低温度,而降低温度时正反应速率一直减小,故B错误;
C.平衡常数K值变大,平衡右移,故C错误;
D.平衡常数K值变大,平衡右移,须降低温度,而降低温度时逆反应速率开始减小,由于平衡右移,生成物的浓度后来增大,故逆反应速率后来增大,故D正确.
故选:AD;
(3)①平衡状态c(H2)=c(CH4)=0.8mol/L,c(CO2)=0.2mol/L;
CO2(g)+4H2(g)?CH4(g)+2H2O(g)
起始量(mol/L):1.0 4.0 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
用CH4表示达到平衡时的正反应速率=$\frac{0.8mol/L}{10min}$=0.08 mol•L-1•min-1;
起始充H2的物质的量=4.0mol/L×2L=8mol;
平衡常数K=$\frac{0.8×1.{6}^{2}}{0.2×0.{8}^{4}}$=25;
故答案为:0.08 mol•L-1•min-1; 8 mol; 25;
②若现在20min时扩大容器体积,瞬间氢气浓度减小,反应速率减小,平衡逆向移动,逆反应速率减小的小到达到平衡状态,氢气的逆反应速率如右图: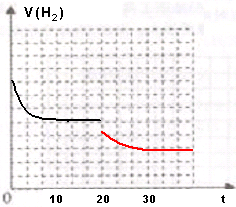 ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡计算与影响因素、反应速率、化学平衡常数、热化学方程式等,难度中等,注意平衡常数计算与应用,题目难度中等.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 试管内气体呈红棕色 | B. | 试管内气体无色,是NO | ||
| C. | 试管内气体无色,是O2 | D. | 试管内液面下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 (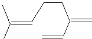 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 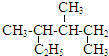 的系统命名是3,4-二甲基己烷 的系统命名是3,4-二甲基己烷 | |
| B. | 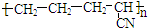 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 是有单体CH2=CH-CH3和CH2=CN发生加聚反应而得到的 | |
| C. | 等质量的甲醛和乳酸[CH3CH(OH)COOH]完全燃烧消耗的氧气不相等,但生成水的质量相等 | |
| D. | 分析反应: ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 ,由于该反应生成了不饱和化合物(含碳氧双键)和小分子,因此该反应属于消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
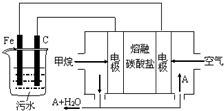 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com