分析:(1)①a.硫酸常温下温度,不易分解.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO
2消耗2molH
2O生成1molH
2SO
4,1molH
2SO
4分解生成1molSO
2与1molH
2O.
d.由Ⅲ可知产生lmolO
2的同时产生2molSO
2,由I可知2molSO
2生成4molHI,由Ⅱ可知4molHI分解生成2mol H
2.
②计算该浓度下的溶度积Qc,与平衡常数k=1比较,若Qc=1,处于平衡状态,若Qc>1,平衡向逆反应移动,若Qc<1,向正反应移动.
③实验室用Zn和稀硫酸制取H
2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大;增大氢离子的浓度、加热、形成原电池等可以加快反应速率.
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡.
b.CH
3OH分解的速率和CH
3OH生成的速率相等,正逆反应速率相等,反应达平衡状态.
c.各物质的浓度不变,说明到达平衡状态.
d.单位时间内消耗1mol CO,同时生成l mol CH
3OH,都表示正反应速率,自始至终都按1:1进行.
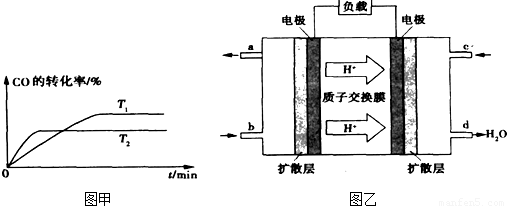
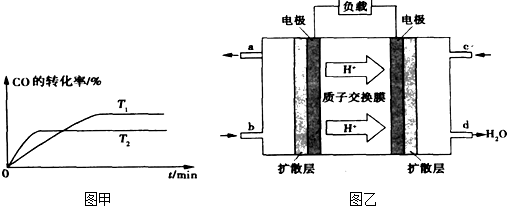
②温度越高反应速率越快,到达平衡时间越短,故T
1<T
2,温度越高CO的转化率越小,升高温度平衡向逆反应移动.
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,正极反应还原反应,氧气在正极放电,负极电极反应式为
CH
3OH(l)+H
2O(l)-6e
-=CO
2(g)+6H
+,正极反应式为O
2+4e
-+4H
+=2H
2O.6.4g甲醇(CH
3OH)的物质的量为
=0.2mol,根据电极反应式计算转移电子的物质的量.
解答:解:(1)①a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,氧化性比HI强,故b错误;
c.1molSO
2消耗2molH
2O生成1molH
2SO
4,1molH
2SO
4分解生成1molSO
2与1molH
2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO
2的同时产生2molSO
2,由I可知2molSO
2生成4molHI,由Ⅱ可知4molHI分解生成2mol H
2,即循环过程中产生l mol O
2的同时产生2mol H
2,故d错误;
故选:c;
②浓度商Qc=
=0.6<1,所以平衡向正反应移动,即v
正>v
逆,故选:>;
③实验室用Zn和稀硫酸制取H
2,随反应进行溶液中氢离子浓度降低,水的电离平衡增大,向右移动;
a.加入NaNO
3,氢离子浓度不变,不能增大氢气的生成速率,故a错误;
b.加入CuSO
4,形成原电池,加快氢气的生成速率,故b正确;
c.加入Na
2SO
4,氢离子浓度不变,不能增大氢气的生成速率,故c错误;
d.加入NaHSO
3,与氢离子反应,氢离子浓度降低,氢气的生成速率降低,故d错误;
故答案为:向右;b;
(2)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
a.恒温、恒容条件下,随反应进行反应混合物的物质的量减小,体系压强减小,容器内的压强不发生变化,说明到达平衡,故a正确;
b.CH
3OH分解的速率和CH
3OH生成的速率相等,正逆反应速率相等,反应达平衡状态,故b正确;
c.CO、H
2和CH
3OH的浓度保持不变,说明到达平衡状态,故c正确;
d.单位时间内消耗1mol CO,同时生成l mol CH
3OH,都表示正反应速率,自始至终都按1:1进行,故d错误;
故选:d;
②温度越高反应速率越快,到达平衡时间越短,故T
1<T
2,温度越高CO的转化率越小,升高温度平衡向逆反应移动,温度平衡常数降低,温度越高平衡常数越小,即K
1>K
2,
故答案为:>;
③由质子的定向移动可知左侧电极为燃料电池的负极,右侧电极为燃料电池的正极,负极发生氧化反应,甲醇在负极放电,故b通入CH
3OH;正极反应还原反应,氧气在正极放电,正极反应式为O
2+4e
-+4H
+=2H
2O;6.4g甲醇(CH
3OH)的物质的量为
=0.2mol,由负极电极反应式为CH
3OH+H
2O-6e
-=CO
2+6H
+可知转移电子的物质的量为0.2mol×6=1.2mol,
故答案为:CH
3OH;O
2+4e
-+4H
+=2H
2O;1.2.



 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______ CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol 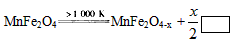 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为: H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题: