
| A、无沉淀生成 | B、肯定没有BaSO3生成 | C、得到的沉淀是纯净物 | D、得到的沉淀是BaSO4和BaSO3组成的混合物 |


科目:高中化学 来源: 题型:阅读理解
| 辅助试剂 |
| 加热 |
| NaOH溶液 |
| 吹出 |
| H3BO3 |
| 吸收 |

| 实验编号 | 样品和辅助试剂 | 消耗盐酸体积/mL |
| 1 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.45 |
| 2 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 25.50 |
| 3 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.55 |
| 4 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 33.50 |
| 5 | 10.00mL液态奶、0.2g催化剂、20mL浓硫酸 | 1.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
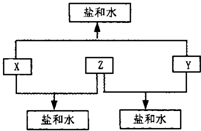 (2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(2010?潍坊一模)已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.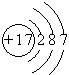
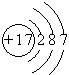
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:






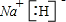
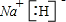
查看答案和解析>>
科目:高中化学 来源: 题型:
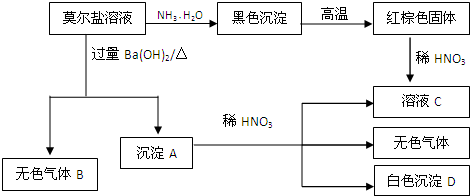
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com