
| A�� | ����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+���� | |
| B�� | ���Ȼ���������Һ�м����Ȼ�����Һ���Ȼ�����Ksp��С | |
| C�� | ��0.0008mol•L-1��K2CrO4��Һ�м�������0.002��mol•L-1��AgNO3��Һ����CrO42-��ȫ���� | |
| D�� | ��0.001mol•L-1AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001��mol•L-1��KCl��K2CrO4�����Һ�У����Ȳ���AgCl���� |
���� A��ǰ�ߵ�c��Ag+��=$\sqrt{1.56��1{0}^{-10}}$=1.25��10-5mol/L�����ߵ�c��Ag+��=$\root{3}{2��1��1{0}^{-12}}$=1.26��10-4mol/L��
B��Kspֻ���¶��йأ�
C�������ʱ���������㣬��ȫ��Ӧ����Ҫ��c��CrO42-��=$\frac{1��1{0}^{-12}}{��1{0}^{-3}��^{2}}$=1��10-6mol/L��
D�����Ksp��c��Ag+������������Ũ�ȣ�������Ũ��С���ȳ�����
��� �⣺A��ǰ�ߵ�c��Ag+��=$\sqrt{1.56��1{0}^{-10}}$=1.25��10-5mol/L�����ߵ�c��Ag+��=$\root{3}{2��1��1{0}^{-12}}$=1.26��10-4mol/L����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ����ߵ�c��Ag+����A����
B��Kspֻ���¶��йأ������Ȼ���������Һ�м����Ȼ�����Һ��ƽ�������ƶ������Ȼ�����Ksp���䣬��B����
C�������ʱc��K2CrO4��=0.0004mol•L-1��c��AgNO3��=0.001mol•L-1��������������ȫ��Ӧ����Ҫ��c��CrO42-��=$\frac{1��1{0}^{-12}}{��1{0}^{-3}��^{2}}$=1��10-6mol/L����֪CrO42-ʣ�࣬��C����
D��c��Cl-��=$\frac{1.56��1{0}^{-10}}{0.001}$=1.56��10-7mol/L��c��CrO42-��=$\frac{1��1{0}^{-12}}{��0.001��^{2}}$=1��10-6mol/L�����������ȳ��������Ȳ���AgCl��������D��ȷ��
��ѡD��
���� ���⿼�����ܵ���ʵ��ܽ�ƽ�⣬Ϊ��Ƶ���㣬����Ksp�ļ��㡢�ܽ�ƽ���ƶ��������ж�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��K�ļ��㣬��Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������� | B�� | ���������� | C�� | ��Һ������ | D�� | ��ɢϵ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ��ʹ���ȳ���ɫ���ʺ죬�ɶ��һЩ�������� | |
| B�� | Ϊ��ʹӤ����ʳƷ��Ũ����Ȥ�����ǿ�����Ӥ��ʳƷ�м�������ɫ�� | |
| C�� | ���ð�˹ƥ�ֺ����θ������Ӧ���ж��ı��֣�Ӧ����ͣҩ | |
| D�� | Ϊ��֤���������㹻����������Ҫ����⣬�ٳ��߲˺�ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
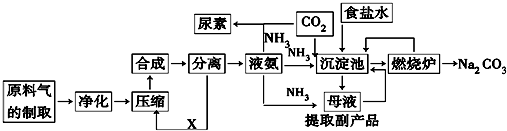
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
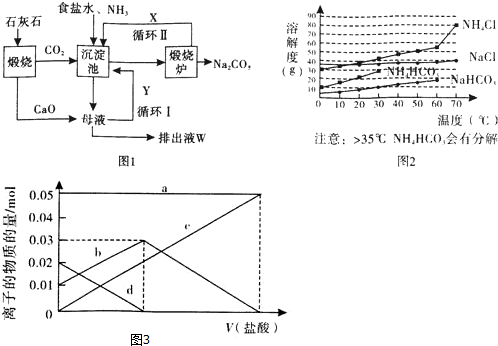
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
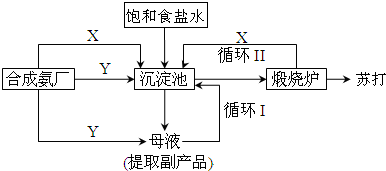
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
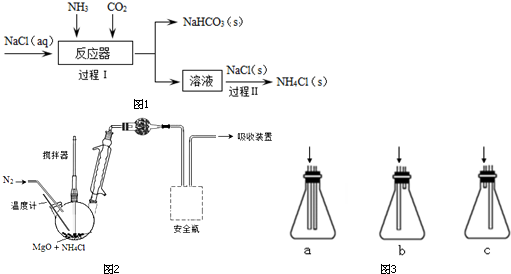
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ijͬѧCr2O72-��aq��+H2O��l��?2CrO42-��aq��+2H+��aq����H=+13.8kJ/mol
ijͬѧCr2O72-��aq��+H2O��l��?2CrO42-��aq��+2H+��aq����H=+13.8kJ/mol| A�� | �÷�Ӧ��һ��������ԭ��Ӧ | |
| B�� | ���Թ�b����Һ��ɫ�����Ŀ����ʹCr2O72-��ȫ��Ӧ | |
| C�� | ��ʵ�鲻��֤����С������Ũ�ȣ�ƽ�������ƶ� | |
| D�� | �Թ�c�е�����˵��Ӱ��ƽ�����Ҫ�������¶� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com