
| A. | 12.3% | B. | 15.4% | C. | 13.4% | D. | 17.0% |
分析 铝、硅燃烧涉及两个反应:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2.固体增重质量就是参加反应的氧气的质量,因求物质的含量,所以可首先将单位调整为克,便于计算,即样品取10 g,反应后固体增重的质量为9.23 g,设Al、Si的物质的量分别为xmol、ymol,列方程计算各自物质的量,进而计算硅的质量分数.
解答 解:铝、硅燃烧涉及两个反应:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Si+O2$\frac{\underline{\;点燃\;}}{\;}$SiO2.固体增重质量就是参加反应的氧气的质量,因求物质的含量,所以可首先将单位调整为克,便于计算,即样品取10 g,反应后固体增重的质量为9.23 g,
设Al、Si的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{27x+28y=10}\\{\frac{3}{4}x×32+32y=9.23}\end{array}\right.$
解得x≈0.32,y≈0.048
故硅的质量分数为$\frac{0.048mol×28g/mol}{10g}$×100%=13.4%,
故选:C.
点评 本题考查混合物有关计算,难度不大,但数据计算稍微繁琐,明确发生的反应即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 只有①⑦ | B. | 除②外都是 | C. | 只有①④⑥⑦ | D. | 只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.1 |
| A. | 0~6 min的平均反应速率:v(H2O2)≈0.33 mol/(L•min) | |
| B. | 6~10 min的平均反应速率:v(H2O2)>3.3×10-2 mol/(L•min) | |
| C. | 反应到6 min时,H2O2分解了60% | |
| D. | 反应到10 min时,c(H2O2)≈0.24 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
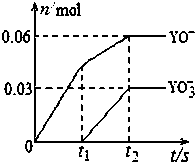 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
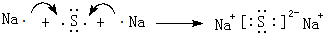 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑧ | B. | ②④⑥⑧⑦ | C. | ①②③④⑤ | D. | 全部不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有3个未成对电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 次外层无未成对电子的原子 | D. | 最外层有8个电子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com