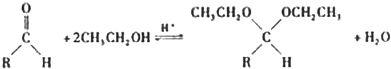(2008?广东)醇氧化成醛的反应是药物、香料合成中的重要反应之一.
(1)苯甲醇可由C
6H
5CH
2Cl在NaOH水溶液中发生取代反应而得,反应方程式为
.
(2)醇在催化剂作用下氧化成醛的反应是绿色化学的研究内容之一.某科研小组研究了把催化剂在氧气气氛中对一系列醇氧化成醛反应的催化效果,反应条件为:K
2CO
3、363K、甲苯(溶剂).实验结果如下:
| 醇 |
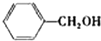 |
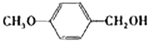 |
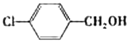 |
| 反应时间/h |
2.5 |
2.5 |
2.5 |
| 醛的产率/% |
95 |
96 |
94 |
| 醇 |
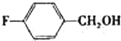 |
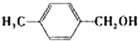 |
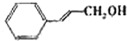 |
| 反应时间/h |
3.0 |
3.0 |
15.0 |
| 醛的产率/% |
95 |
92 |
40 |
分析表中数据,得到把催化剂催化效果的主要结论是
苯环上的取代基对醛的产率影响不大,对反应时间有一定影响及与羟基相连的碳链长,大大降低醛的产率与增大反应时间
苯环上的取代基对醛的产率影响不大,对反应时间有一定影响及与羟基相连的碳链长,大大降低醛的产率与增大反应时间
(写出2条).
(3)用空气代替氧气气氛进行苯甲醇氧化生成苯甲醛的反应,其他条件相同,产率达到95%时的反应时间为7.0小时.请写出用空气代替氧气气氛进行反应的优缺点:
优点为原料易得,降低成本,防止苯甲醛氧化为苯甲酸;缺点为令反应时间增长
优点为原料易得,降低成本,防止苯甲醛氧化为苯甲酸;缺点为令反应时间增长
.
(4)苯甲醛易被氧化.写出苯甲醛被银氨溶液氧化的反应方程式
C
6H
5CHO+2Ag(NH
3)
2OH
C
6H
5COONH
4+2Ag↓+3NH
3↑+H
2O
C
6H
5CHO+2Ag(NH
3)
2OH
C
6H
5COONH
4+2Ag↓+3NH
3↑+H
2O
(标出具体反应条件).
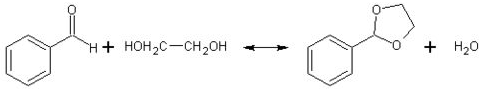
(5)在药物、香料合成中常利用醛和醇反应生成缩醛来保护醛基,此类反应在酸催化下进行.例如:
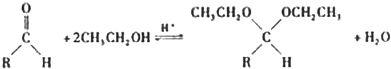
①在以上醛基保护反应中要保证反应的顺利进行,可采取的措施有
CH3CH2OH过量,令化学平衡向正反应方向移动或边反应边蒸馏缩醛脱离反应体系,令化学平衡向正反应方向移动
CH3CH2OH过量,令化学平衡向正反应方向移动或边反应边蒸馏缩醛脱离反应体系,令化学平衡向正反应方向移动
(写出2条).
②已知具有五元环和六元环结构的缩醛比较稳定.写出用乙二醇(HOCH
2CH
3OH)保护苯甲醛中醛基的反应方程式
.

 2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 N2(g)+3H2(g)的平衡常数.
N2(g)+3H2(g)的平衡常数. ;
; 2NH3(g)
2NH3(g) N2(g)+3H2(g)的平衡常数为5.0×10-3mol2/L2.
N2(g)+3H2(g)的平衡常数为5.0×10-3mol2/L2.