
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是
A.Z元素的氧化物对应水化物的酸性一定弱于W
B.四种元素中Z的原子半径和形成的离子半径均最大
C.X、Z、W中最简单气态氢化物稳定性最弱的是Z
D.X、Y、Z的原子均能与氢原子形成四原子分子

科目:高中化学 来源: 题型:
按要求填写下列相关内容:
(1)在常温下,有体积为Va升、pH值为a的稀硫酸和体积为Vb升, pH值为b的烧碱溶液混和,若所得混合液为中性。如果a+b=13,则Va∶Vb=________。
某温度时,水的离子积常数KW=1×10-13。在此温度下,将pH=a的硫酸溶液Va L与pH=b的NaOHVb L混合,若所得混合液为中性,如果a+b=13,则Va∶Vb=________。
(2)中和相同体积,相同pH的Ba(OH)2、NaOH、和NH3·H2O三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为 。
(3)今有 a.盐酸 b.硫酸 c.醋酸 三种酸:
①在同体积、同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。(填酸的序号和符号>、<、=表示,下同)。
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是_________________,反应所用时间长短关系是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101 时,
时,
②稀溶液中: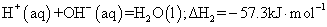
下列说中正确的是
A、若碳的燃烧热用 表示,则B、若碳的燃烧热用
表示,则B、若碳的燃烧热用 表示,则
表示,则
C、浓硫酸与稀 溶液反应的中和热值为57.3kJ·mol-1
溶液反应的中和热值为57.3kJ·mol-1
D、稀醋酸与稀 溶液反应生成1mol水,放出57.3kJ的热量
溶液反应生成1mol水,放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1
D.1/2CH4(g) + O2(g) == 1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀氨水中存在下述电离平衡NH3+H2O  NH3 ·H2O
NH3 ·H2O  NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | |||
| 平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
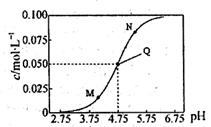
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是
A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l
B.M点所表示的溶液中:
c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1
C.N点所表示的溶液中:
c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分类,完全正确的是
| A | B | C | D | |
| 强电解质 | H2SO4 | NaCl | HClO | HNO3 |
| 弱电解质 | HF | NH3 | CaCO3 | H2CO3 |
| 非电解质 | Cl2 | CH3COOH | C2H5OH | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一洁净锥形瓶中,先用酸式滴定管准确移取25.00mL某未知浓度的盐酸于其中,再用0.20mol·L-1的NaOH溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10 mL | 18.60 mL |
| 第二次 | 0.30 mL | 18.00 mL |
(1)根据以上表格中数据可以计算出盐酸的物质的量浓度为 mol·L-1
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A.未用标准液润洗碱式滴定管
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
C.配制标准溶液的氢氧化钠中混有Na2CO3杂质
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
E.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH= -226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热ΔH= -566 kJ/mol B.CO的热值约为10.1kJ/g
C.2Na2O2(s) + 2CO2(s)= 2Na2CO3(s) + O2(g) ΔH< -452 kJ/mol
D.CO(g)与Na2O2(s)反应放出50.9 kJ热量时,电子转移为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com