
在一定条件下HI、Fe、FeBr2分别与足量的Cl2反应,如果三个反应电子转移数目相等,则HI、Fe、FeBr2的物质的量之比为
A.1:1:1 B.3:1:1
C.1:3:3 D.6:3:2
科目:高中化学 来源:2015-2016学年青海省高一下期末化学试卷(解析版) 题型:选择题
下列关于碱金属的叙述正确的是( )
A. 随着核电荷数的增加,它们的密度逐渐减小
B. 随着核电荷数的增加,单质的熔点,沸点升高
C. 随着核电荷数的增加,单质与水反应的剧烈程度增大
D. 随着核电荷数的增加,离子的氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三上学期第一次质检化学试卷(解析版) 题型:选择题
下列有关物质用途的说法中,不正确的是
A.氢氟酸可用来刻蚀玻璃 B.过氧化钠常用作供氧剂
C.晶体硅可用于制作光导纤维 D.漂白粉可用作游泳池的消毒剂
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:选择题
下列粒子组在指定介质中一定能大量共存的是
A.酸性溶液中:C2H5OH、Na+、MnO4-、NO3-
B.溶有二氧化硫气体的溶液中:NH4+、Fe2+、SO42-、Cl-
C.加入铝产生H2的溶液:Na+、K+、HCO3-、AlO2-
D.常温下,水电离c(H+)=1×10-10mol·L-1的溶液:Al3+、Cu2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第一次月考理综化学试卷(解析版) 题型:填空题
工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 _;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
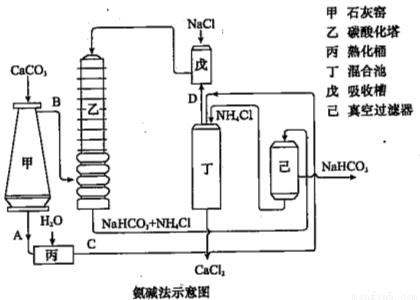
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法对氨碱法的改进,其优点是 ;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?
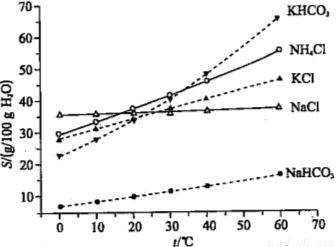
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第一次月考理综化学试卷(解析版) 题型:选择题
下列各组物质分类方法正确的一组是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 硫酸 | 水煤气 | 盐酸 | 硫化氢 | 二氧化碳 |
B | 冰醋酸 | Fe(OH)3胶体 | 碳酸钙 | 氟化氢 | 氨气 |
C | 纯碱 | 酒精溶液 | 硫酸钡 | 氨水[ | 三氧化硫 |
D | 大理石 | 福尔马林 | 氢氧化钡 | 碘化氢 | 甲烷 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
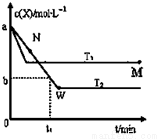
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=(a—b)/t1 mol/(L.min)
C.M点的正反应速率v正大于N点的逆反应速率V逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确( )
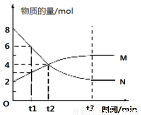
A.反应的化学方程式为:2M?N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期末化学试卷(解析版) 题型:选择题
已知R2-阴离子核外有a个电子,b个中子,表示R原子符号正确的是( )
A. 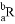 B.
B. 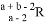 C.
C. 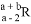 D.
D. 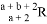
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com