
| ||
| ||
| ||
| 64 |
| 64+56+64 |
| 2 |
| 3 |
| 6 |
| 2 |
| 2 |
| 3 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ˮ�����c��H+������=��=��=�� |
| B��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| C�����ڡ�����Һ��Ϻ���pH=7����������Һ��������ڣ��� |
| D��������Һ��ϡ��100������Һ��pH���ۣ��ܣ��ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
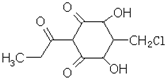
| A�������ʵķ���ʽΪ��C10H7O5Cl |
| B��1mol�������ڳ�����������3mol NaOH��Ӧ |
| C����������FeCl3��Һ���ܷ�����ɫ��Ӧ |
| D�������ʿɷ���ȡ������������ȥ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ձ���һ�����ᷢ�������ӷ�Ӧ�У�2Na+2H2O�T2Na++2OH-+H2�� |
| B�������ձ����ƾ���Һ���Ͼ��ҷ�Ӧ����ȶ��ԣ�X�ձ��еķ�Ӧƽ��Щ |
| C��Z�ձ���һ�����г������ɣ����������ǵ���ͭ |
| D�������ձ�����������������ʵ�����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
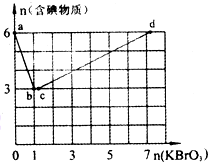 ����6 mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
����6 mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ս� | B����� | C������ | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��COת��ΪCO2���Ȼ�ѧ����ʽΪ2CO��g��+O2��g���T2CO2��g����H=-566 kJ?mol-1 | ||
B��COȼ���ȵ��Ȼ�ѧ����ʽΪCO��g��+
| ||
| C�����ȷ�Ӧ������Ҫ���Ȳ��ܽ��У������ȷ�Ӧһ����Ҫ���Ȳ��ܽ��� | ||
| D��1mol H2��ȫȼ������1mol Һ̬ˮ���ų�����������242 kJ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com