
(11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:阅读理解
 .
.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源:2012届江苏省扬州中学高三上学期练习化学试卷 题型:实验题
(15分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。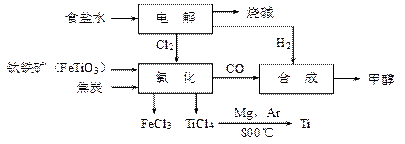
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: ▲ 。
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)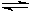 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 ▲ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 ▲ t。
(3)用甲醇—空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),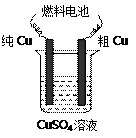
在接通电路一段时间后纯Cu质量增加3.2 g。
①请写出燃料电池中的负极反应式: ▲ 。
②燃料电池正极消耗空气的体积是 ▲ (标准状况,
空气中O2体积分数以20%计算)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三上学期练习化学试卷 题型:实验题
(15分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
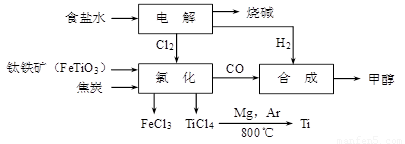
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: ▲ 。
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 ▲ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2 ▲ t。
(3)用甲醇—空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),
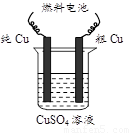
在接通电路一段时间后纯Cu质量增加3.2 g。
①请写出燃料电池中的负极反应式: ▲ 。
②燃料电池正极消耗空气的体积是 ▲ (标准状况,
空气中O2体积分数以20%计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com