
下列实验中不能获得成功的是( )
A. 用水检验苯和溴苯 B. 苯、浓硫酸、浓硝酸共热制硝基苯
C. 用溴水除去混在苯中的己烯 D. 苯、液溴、溴化铁混合制溴苯
科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下难分解,而H2S在300℃时就分解,说明O非金属性比S强 | |
| B. | H2CO3的酸性比HClO的酸性强,所以C的非金属性比Cl强 | |
| C. | NaOH的碱性比Mg(OH)2的碱性强,所以Na的金属性比Mg强 | |
| D. | Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:1 | B. | 1:2:3 | C. | 2:3:6 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
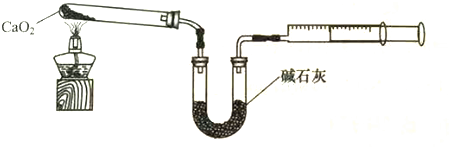
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:填空题
等物质的量的乙烯与甲烷,所含分子数之比为_____________,碳原子个数之比为_____________,氢原子个数之比为______________,若充分燃烧,消耗O2的体积比为_________;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列关于烷烃性质的叙述中,不正确的是( )
A.烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高
B.烷烃都能使溴水、酸性KMnO4溶液褪色
C.烷烃跟卤素单质在光照条件下能发生取代反应
D.烷烃同系物的密度随着相对分子质量的增大逐渐增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
某温度下,pH相同的盐酸和醋酸溶液加水稀释后随溶液体积变化的曲线如右图所示。据图判断正确的是( )

A.Ⅱ为盐酸稀释时pH值变化曲线 B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强 D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:实验题
锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位。现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品。
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473-1573K,使锌蒸馏出来。将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为。
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作。
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是。
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为________
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下:

已知:25℃时,Ksp(CaSO4)=4.9×10-5,KSP(PbSO4)=1.6×10-8。
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+。写出Pb参加反应的化学方程式_____________________。
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是使Ag留在浸出渣中,产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去附着在硫酸铅表面的微溶物硫酸钙。沉淀转化反应的离子方程式是___。
③母液中可循环利用的溶质的化学式是_____________(填一种物质)
(4)现向含Pb2+、Ca2+浓度均为0.10mol/L的混合溶液中滴加0.10mol/LSO42-溶液.当Pb2+沉淀完全时,溶液中Ca2+浓度为mol/L
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
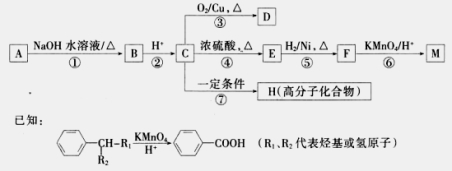
请回答:
(1)B、F的结构简式分别为____________、。
(2)反应①~⑦中,属于氧化反应的是________(填反应序号)。
(3)写出反应④的化学方程式__________________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为_______________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,下列确定该官能团的哪些实验方法是正确的________。
A.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
B.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
C.取少量A于试管中,再滴入AgNO3溶液,再加入稀硝酸.观察沉淀颜色
D.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有______种。
A.能发生银镜反应
B.能与FeCl3溶液发生显色反应
C.核磁共振氢谱上有四个峰,其蜂面积之比为l:1:2:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com