
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4162 | 18.25 |
| 2 | 17.04 | |
| 3 | 16.96 |

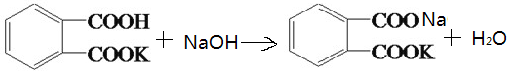 ;
;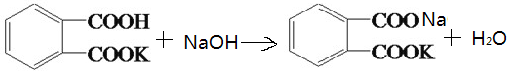 ;
;| m |
| M |
| 17.04+16.96 |
| 2 |
| n |
| V |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:单选题
| A.用滤纸擦干净后才能使用 |
| B.用水多洗几次 |
| C.用稀盐酸洗涤后,再灼烧到无颜色时为止 |
| D.先用稀盐酸洗涤,后用水洗涤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
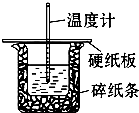
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
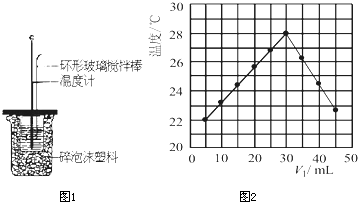
| 温度 | 起始温度t1/℃ | 终止温度 t1/℃ | 温度差 (t2-t1)t1/℃ | ||
| 实验次数 | H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
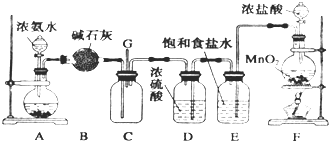
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com