
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
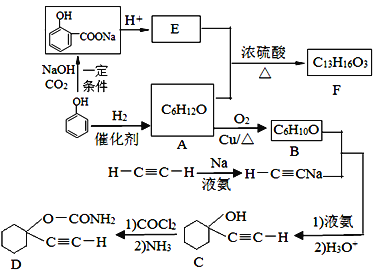
(1)A的化学名称是_________,C中含氧官能团的名称为_______________。
(2)F的结构简式为_______________,A和E生成F的反应类型为_______________。
(3)B与乙炔钠合成C的反应类型(酸化前)是______________;写出由C合成D的第二个反应的化学方程式___________________________________。
(4)同时满足下列条件的E的同分异构体有__________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
(5)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。_________
【答案】环己醇 羟基 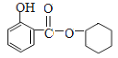 酯化(取代)反应 加成反应
酯化(取代)反应 加成反应 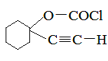 +NH3→
+NH3→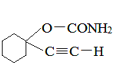 +HCl 9
+HCl 9 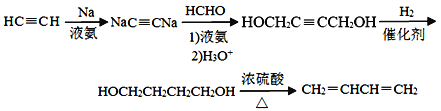
【解析】
![]() 与H2在催化剂作用下发生加成反应生成A,其结构简式为
与H2在催化剂作用下发生加成反应生成A,其结构简式为![]() ;
;![]() 催化氧化可生成B,结构简式为
催化氧化可生成B,结构简式为![]() ;
;![]() 与H-C≡CNa可发生加成反应生成
与H-C≡CNa可发生加成反应生成![]() ,酸化后生成C(
,酸化后生成C(![]() ),
),![]() 与SOCl2反应生成
与SOCl2反应生成![]() ,
,![]() 与NH3反应生成D(
与NH3反应生成D(![]() )。
)。![]() 酸化后生成E,其结构简式为
酸化后生成E,其结构简式为![]() ,
,![]() 与
与![]() 发生酯化反应生成F,其结构简式为
发生酯化反应生成F,其结构简式为![]() 。
。
(1)A的结构简式为![]() ,化学名称是环己醇,C的结构简式为
,化学名称是环己醇,C的结构简式为![]() ,含氧官能团的名称为羟基。答案为:环己醇;羟基;
,含氧官能团的名称为羟基。答案为:环己醇;羟基;
(2)由以上分析可知,F的结构简式为![]() ,
,![]() 和
和![]() 生成
生成![]() 的反应类型为酯化(取代)反应。答案为:
的反应类型为酯化(取代)反应。答案为:![]() ;酯化(取代)反应;
;酯化(取代)反应;
(3) ![]() 与H-C≡CNa合成
与H-C≡CNa合成![]() ,反应类型(酸化前)是加成反应;由
,反应类型(酸化前)是加成反应;由![]() 合成
合成![]() 的化学方程式为
的化学方程式为![]() +NH3→
+NH3→![]() +HCl。答案为:加成反应;
+HCl。答案为:加成反应;![]() +NH3→
+NH3→![]() +HCl;
+HCl;
(4)同时满足条件:“①遇FeCl3溶液发生显色反应;②能发生银镜反应”的E的同分异构体中,应含有1个-OH(酚)、1个-OOCH(3种异构体),或2个-OH(酚)、1个-CHO(6种异构体),异构体共有9种(不含立体异构)。答案为:9;
(5)以乙炔和甲醛为起始原料,利用题给流程图中![]() 与H-C≡CNa的反应原理,将HC≡CH转化为NaC≡CNa,然后与HCHO进行加成,生成HOCH2C≡CCH2OH,与H2加成生成HOCH2CH2CH2CH2OH,再发生消去反应从而得到目标有机物。合成路线为:
与H-C≡CNa的反应原理,将HC≡CH转化为NaC≡CNa,然后与HCHO进行加成,生成HOCH2C≡CCH2OH,与H2加成生成HOCH2CH2CH2CH2OH,再发生消去反应从而得到目标有机物。合成路线为:
.  。答案为:
。答案为: 。
。


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】水垢中含有的 CaSO4,可先用 Na2CO3 溶液处理,使之转化为疏松、易溶于酸的 CaCO3。某化学兴趣小组用某浓度的 Na2CO3 溶液处理一定量的 CaSO4 固体,测得所加 Na2CO3 溶液体积与溶液中-lgc(CO32-)的关系如下:
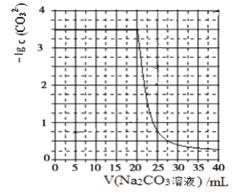
已知Ksp(CaSO4)=9×10-6,Ksp(CaCO3)=3×10-9,lg3=0.5,下列说法不正确的是
A.曲线上各点的溶液满足关系式![]()
B.CaSO4(s)+ ![]() (aq)
(aq)![]() CaCO3(s)+
CaCO3(s)+![]() (aq)K=3×103
(aq)K=3×103
C.该Na2CO3溶液的浓度为1.5 mol/L
D.相同实验条件下,若将Na2CO3溶液的浓度改为原浓度的2倍,则上图曲线整体向上平移1个单位即可
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计的糖厂甘蔗渣利用方案如下图所示:
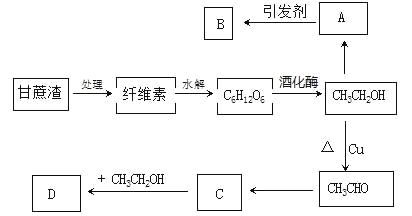
其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。
请回答以下问题:
(1)“C6H12O6”所示的物质的名称是_________,A的电子式为_______________。
(2)写出下列转化的化学方程式并指出反应类型:
A→B___________________________________,反应类型__________________。
C→D____________________________________,反应类型__________________。
CH3CH2OH→CH3CHO:___________________________________,反应类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数。下列说法不正确的是
A.常温常压下,35.5g的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5NA
B.60g甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2NA
C.同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA
D.已知合成氨反应:N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4kJ/mol,当该反应生成NA个NH3分子时,反应放出的热量为46.2kJ
2NH3(g);△H=-92.4kJ/mol,当该反应生成NA个NH3分子时,反应放出的热量为46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/LH2R(二元弱酸)溶液中滴加0.1mol/LNaOH溶液,溶液pH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是

A. a点所示溶液中:c (H2R) + c (HR-)+ c (R2-)=0.lmol/L
B. b点所示溶液中:c (Na+) >c(HR-)> c (H2R)>c(R2-)
C. 对应溶液的导电性:b > c
D. a、b、c、d中,d点所示溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌猛干电池是日常生活中常用的一次电池。一种处理废旧干电池的流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. “水浸”后的滤渣干燥后经充分灼烧可回收其中的MnO2
C. “沉淀”反应后的滤液可通过蒸发至干回收NH4Cl
D. “沉淀”反应的离子方程式为:Zn2+ + 2NH3·H2O = Zn(OH)2↓ + 2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:______ min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是______ (填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图。
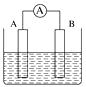
①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的正极反应式:_______。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:______;该电池在工作时,A电极的质量将______(填“增加”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
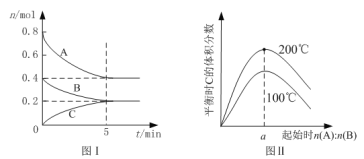
A.200℃时,反应从开始到平衡的平均速率v(B)= 0. 04 mol·L-1·min-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的 △H<0,且a =2
zC(g)的 △H<0,且a =2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0°C | 0.5 molL1稀硫酸 | 4 min 左右出现蓝色 |
② | 20°C | 1 min 左右出现蓝色 | ||
③ | 20°C | 0.1 molL1稀硫酸 | 15 min 左右出现蓝色 | |
④ | 20°C | 蒸馏水 | 30 min 左右出现蓝色 |
(1)为探究温度对反应速率的影响,实验②中试剂 A 应为______________。
(2)写出实验③中 I-反应的离子方程式:_____________________。
(3)对比实验②③④,可以得出的结论:_______________________。
(继续探究)溶液 pH 对反应速率的影响查阅资料:
i.pH<11.7 时,I-能被O2 氧化为 I2。
ii.pH= 9.28 时,I2发生歧化反应:3I2 +6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快。
(4)小组同学用 4 支试管在装有 O2 的储气瓶中进行实验,装置如图所示。
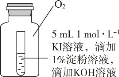
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的 pH | 8 | 9 | 10 | 11 |
放置 10 小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
分析⑦和⑧中颜色无明显变化的原因_______。
(5)甲同学利用原电池原理设计实验证实 pH=10 的条件下确实可以发生 I-被 O2 氧化为 I2 的反应,如图所示,请你填写试剂和实验现象。
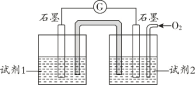
试剂1______________。 试剂2______________。实验现象:___________________________。
(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。
序号 | 温度 | 试剂 | 现象 |
⑨敞口试管 | 水浴 70°C | 5 mL 1 molL1 KI 溶液 5 mL 0.5 molL1 稀硫酸 | 20 min 内仍保持无色,冷却至室温后滴加淀粉溶液出现蓝色 |
⑩密闭试管 | 溶液迅速出现黄色,且黄色逐渐加深,冷却至室温后滴加淀粉溶液出现蓝色 |
(6)对比实验⑨和⑩的现象差异,该小组同学对实验⑨中的现象提出两种假设,请你补充假设 1。
假设 1:_______________。
假设 2:45°C 以上 I2 易升华,70°C 水浴时,c(I2)太小难以显现黄色。
(7)针对假设 2 有两种不同观点。你若认为假设 2 成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因_______________(写出一条)。你若认为假设 2 不成立,请设计实验方案证明_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com