
ЁОЬтФПЁПИјФуЬсЙЉДПаПЁЂДПЭЦЌКЭ500 mL 0.4 molЁЄLЃ1ЕФH2SO4ШмвКЁЂЕМЯпЁЂ1000 mLСПЭВЁЃЪдгУЯТЭМзАжУРДВтЖЈаПКЭЯЁСђЫсЗДгІЪБдкФГЖЮЪБМфФкЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЁЃ

ЃЈ1ЃЉШчЭМЫљЪОЃЌзАжУЦјУмадСМКУЃЌЧв1 000 mLСПЭВжавбГфТњСЫЫЎЃЌдђПЊЪМЪЕбщЪБЃЌЪзЯШвЊ______ЁЃ
ЃЈ2ЃЉaЕчМЋВФСЯЮЊ________ЃЌЦфЕчМЋЗДгІЪНЮЊ______________ЁЃbЕчМЋВФСЯЮЊ________ЃЌЦфЕчМЋЗДгІЪНЮЊ______________ЁЃ
ЃЈ3ЃЉ ЕБСПЭВжаЪеМЏ672 mLЦјЬхЪБ(вбелЫуЕНБъзМзДПіЯТ)ЃЌЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЮЊ_______ЁЃ
ЁОД№АИЁП
ЃЈ1ЃЉгУЕМЯпАбaЁЂbСНЕчМЋСЌНгЦ№РД
ЃЈ2ЃЉДПаПЦЌЃЛZnЃ2eЃ===Zn2ЃЋ ЃЛДПЭЦЌЃЛ2HЃЋЃЋ2eЃ===H2Ёќ
ЃЈ3ЃЉ0.06 mol
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЃЈ1ЃЉШєгУШчЭМзАжУРДВтЖЈаПКЭЯЁСђЫсЗДгІЪБдкФГЖЮЪБМфФкЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЃЌПЩвдгУЕМЯпАбaЁЂbСНЕчМЋСЌНгЦ№РДЃЌЭЈЙ§ВтСПВњЩњЕФЧтЦјЕФЬхЛ§РДМЦЫуЁЃ
ЃЈ2ЃЉгЩгкдке§МЋЩЯЗЂЩњЛЙдЗДгІВњЩњЧтЦјЃЌРДЪеМЏВтСПЃЌЫљвдaЕчМЋЪЧИКМЋЃЌЗЂЩњбѕЛЏЗДгІЃЌЕчМЋВФСЯЪЧДПаПЃЌИУЕчМЋЕФЗДгІЪНЮЊZnЃ2eЃ===Zn2ЃЋЃЛbЕчМЋЪЧе§МЋЃЌЕчМЋВФСЯЪЧЭЦЌЃЌЕчМЋЗДгІЪНЮЊ2HЃЋЃЋ2eЃЃНH2ЁќЃЛ
ЃЈ3ЃЉЕБСПЭВжаЪеМЏ672 mLЦјЬхЪБ(вбелЫуЕНБъзМзДПіЯТ)ЃЌЧтЦјЕФЮяжЪЕФСПЪЧ0.672LЁТ22.4L/molЃН0.03molЃЌЫљвдЭЈЙ§ЕМЯпЕФЕчзгЕФЮяжЪЕФСПЮЊ0.03molЁС2ЃН0.06molЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщдЊЫиаджЪЛђдзгНсЙЙЕФЕнБфЃЌа№ЪіВЛе§ШЗЕФЪЧЃЈ ЃЉ
A. NaЁЂMgЁЂAlдзгзюЭтВуЕчзгЪ§вРДЮдіЖр
B. PЁЂSЁЂClдЊЫизюИпе§ЛЏКЯМлвРДЮдіДѓ
C. NЁЂOЁЂFЕУЕчзгФмСІвРДЮМѕШѕ
D. LiOHЁЂNaOHЁЂKOHЕФМюадж№НЅдіЧП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїжжБфЛЏжа,ВЛЪєгкЛЏбЇБфЛЏЕФЪЧ
AЃЎЯђМІЕААзШмвКжаЕЮШыБЅКЭСђЫсяЇШмвК,ЮіГіАзЩЋГСЕэ
BЃЎМгШШЕЈЗЏЕУЕНАзЩЋЕФЮоЫЎСђЫсЭЗлФЉ
CЃЎЯђЗаЫЎжаЕЮШыБЅКЭТШЛЏЬњШмвК,жЦШЁЧтбѕЛЏЬњНКЬх
DЃЎЯђМІЕААзШмвКжаЕЮШыЯѕЫсЧІШмвК,ЮіГіАзЩЋГСЕэ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкдЊЫиXЁЂYЁЂZЁЂMЕФдзгађЪ§вРДЮдіДѓЃЌдЊЫиXЕФвЛжжИпгВЖШЕЅжЪЪЧБІЪЏЃЌY2+ЕчзгВуНсЙЙгыФЪЯрЭЌЃЌZЕФжЪзгЪ§ЮЊХМЪ§ЃЌЪвЮТЯТMЕЅжЪЮЊЕЛЦЩЋЙЬЬхЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉMдЊЫиЮЛгкжмЦкБэжаЕФЕк______жмЦкЁЂ_______зхЁЃ
ЃЈ2ЃЉZдЊЫиЪЧ____ЃЌЦфдкздШЛНчжаГЃМћЕФЖўдЊЛЏКЯЮяЪЧ____ЁЃ
ЃЈ3ЃЉXгыMЕФЕЅжЪдкИпЮТЯТЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______ЃЌВњЮяЗжзгЮЊжБЯпаЮЃЌЦфЛЏбЇМќЪє__________ЙВМлМќЃЈЬюЁАМЋадЁБЛђЁАЗЧМЋадЁБЃЉЁЃ
ЃЈ4ЃЉЫФжждЊЫижаЕФ____ПЩгУгкКНПеКНЬьКЯН№ВФСЯЕФжЦБИЃЌЦфЕЅжЪгыЯЁбЮЫсЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГгаЛњЛЏКЯЮяAКЌЬМ77ЃЎ8ЃЅЃЌЧт7ЃЎ40ЃЅЃЌЦфгрЮЊбѕЃЌAЕФЯрЖдЗжзгжЪСПЮЊМзЭщЕФ6.75БЖЁЃ
ЃЈ1ЃЉЪдМЦЫуШЗЖЈИУгаЛњЮяЕФЗжзгЪНЃЈаДГіМђУїМЦЫуЙ§ГЬЃЉЁЃ
ЃЈ2ЃЉКьЭтЙтЦзВтЖЈЃЌAЗжзгНсЙЙжаКЌгаБНЛЗКЭєЧЛљЁЃдкГЃЮТЯТAПЩгыХЈфхЫЎЗДгІЃЌ1mol AзюЖрПЩгы2 molBr2зїгУЃЌОнДЫШЗЖЈИУгаЛњЮяПЩФмЕФНсЙЙМђЪНЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
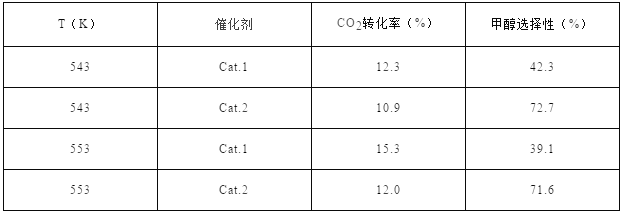
ЁОЬтФПЁПДпЛЏЛЙдCO2ЪЧНтОіЮТЪваЇгІМАФмдДЮЪЬтЕФживЊЪжЖЮжЎвЛЁЃбаОПБэУїЃЌдкCu/ZnOДпЛЏМСДцдкЯТЃЌCO2КЭH2ПЩЗЂЩњСНИіЦНКтЗДгІЃЌЗжБ№ЩњГЩCH3OHКЭCOЁЃЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
CO2ЃЈgЃЉ+3 H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CO2ЃЈgЃЉ+ H2ЃЈgЃЉ![]() COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
ФГЪЕбщЪвПижЦCO2КЭH2ГѕЪМЭЖСЯБШЮЊ1:2.2ЃЌОЙ§ЯрЭЌЗДгІЪБМфВтЕУШчЯТЪЕбщЪ§ОнЃК

ЁОБИзЂЁПCat.1:Cu/ZnOФЩУзАєЃЛCat.2:Cu/ZnOФЩУзЦЌЃЛМзДМбЁдёадЃКзЊЛЏЕФCO2жаЩњГЩМзШЉЕФАйЗжБШ
вбжЊЃКЂйCOКЭH2ЕФБъзМШМЩеШШЗжБ№ЮЊ-283.0kJЁЄmol-1КЭ-285.8kJЁЄmol-1
ЂкH2OЃЈlЃЉ![]() H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
ЧыЛиД№ЃЈВЛПМТЧЮТЖШЖдІЄHЕФгАЯьЃЉЃК
ЃЈ1ЃЉЗДгІIЕФЦНКтГЃЪ§БэДяЪНK= ЃЛЗДгІIIЕФІЄH2= kJЁЄmol-1ЁЃ
ЃЈ4ЃЉдкЭМжаЗжБ№ЛГіIдкЮоДпЛЏМСЁЂгаCat.1КЭгЩCat.2Ш§жжЧщПіЯТЁАЗДгІЙ§ГЬ-ФмСПЁБЪОвтЭМЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФме§ШЗБэЪОЯТСаЗДгІЕФРызгЗНГЬЪНЪЧ
AЃЎХЈбЮЫсгыЬњаМЗДгІЃК2Fe+6H+=2Fe3++3H2Ёќ
BЃЎФЦгыCuSO4ШмвКЗДгІЃК2Na+Cu2+=CuЁ§+2Na+
CЃЎNaHCO3ШмвКгыЯЁH2SO4ЗДгІЃКCO32-+2H+=H2O+CO2Ёќ
DЃЎЧтбѕЛЏФЦШмвКЮќЪеЩйСПSO2ЦјЬхЃКSO2+2OHЃ=SO32Ѓ+H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДпЛЏЛЙдCO2ЪЧНтОіЮТЪваЇгІМАФмдДЮЪЬтЕФживЊЪжЖЮжЎвЛЁЃбаОПБэУїЃЌдкCu/ZnOДпЛЏМСДцдкЯТЃЌCO2КЭH2ПЩЗЂЩњСНИіЦНКтЗДгІЃЌЗжБ№ЩњГЩCH3OHКЭCOЁЃЗДгІЕФШШЛЏбЇЗНГЬЪНШчЯТЃК
CO2ЃЈgЃЉ+3 H2ЃЈgЃЉ![]() CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CH3OHЃЈgЃЉ+H2OЃЈgЃЉІЄH1=-53.7kJЁЄmol-1 I
CO2ЃЈgЃЉ+ H2ЃЈgЃЉ![]() COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
COЃЈgЃЉ+H2OЃЈgЃЉІЄH2 II
ФГЪЕбщЪвПижЦCO2КЭH2ГѕЪМЭЖСЯБШЮЊ1:2.2ЃЌОЙ§ЯрЭЌЗДгІЪБМфВтЕУШчЯТЪЕбщЪ§ОнЃК
ЁОБИзЂЁПCat.1:Cu/ZnOФЩУзАєЃЛCat.2:Cu/ZnOФЩУзЦЌЃЛМзДМбЁдёадЃКзЊЛЏЕФCO2жаЩњГЩМзШЉЕФАйЗжБШ
вбжЊЃКЂйCOКЭH2ЕФБъзМШМЩеШШЗжБ№ЮЊ-283.0kJЁЄmol-1КЭ-285.8kJЁЄmol-1
ЂкH2OЃЈlЃЉ![]() H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
H2OЃЈgЃЉ ІЄH3=44.0kJЁЄmol-1
ЧыЛиД№ЃЈВЛПМТЧЮТЖШЖдІЄHЕФгАЯьЃЉЃК
ЃЈ5ЃЉбаОПжЄЪЕЃЌCO2вВПЩдкЫсадЫЎШмвКжаЭЈЙ§ЕчНтЩњГЩМзДМЃЌдђЩњГЩМзДМЕФЗДгІЗЂЩњдк МЋЃЌИУЕчМЋЗДгІЪНЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП298KЪБЃЌдк20.0mL 0.10mol![]() АБЫЎжаЕЮШы0.10 mol
АБЫЎжаЕЮШы0.10 mol![]() ЕФбЮЫсЃЌШмвКЕФpHгыЫљМгбЮЫсЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЁЃвбжЊ0.10 mol
ЕФбЮЫсЃЌШмвКЕФpHгыЫљМгбЮЫсЕФЬхЛ§ЙиЯЕШчЭМЫљЪОЁЃвбжЊ0.10 mol![]() АБЫЎЕФЕчРыЖШЮЊ1.32%ЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
АБЫЎЕФЕчРыЖШЮЊ1.32%ЃЌЯТСагаЙиа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎИУЕЮЖЈЙ§ГЬгІИУбЁдёЗгЬЊзїЮЊжИЪОМС
BЃЎMЕуЖдгІЕФбЮЫсЬхЛ§ЮЊ20.0 mL
CЃЎMЕуДІЕФШмвКжаc(NH4ЃЋ)ЃНc(ClЃ)ЃНc(HЃЋ)ЃНc(OHЃ)
DЃЎNЕуДІЕФШмвКжаpH<12
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com