
【题目】一定量的Fe、FeO、Fe2O3固体混合物,恰好溶解在0.1 mol盐酸中,并生成224mL(标况)的氢气。取同质量的上述固体与足量的CO高温反应后,固体质量减少( )
A. 条件不足 B. 0.72g C. 0.48g D. 0.64g
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是
A. 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42-
B. 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32-
C. 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl-
D. 0.1mol/LAlO2-溶液中:Na+、K+、SO32-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为
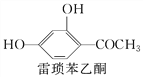

下列说法不正确的是( )
A. 雷琐苯乙酮、苹果酸和伞形酮各1 mol与足量Na反应生成H2体积之比为2∶3∶1
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗4 mol H2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味。工业上,提纯粗硅的原理如下:
![]()
(1)已知:① Si(s)+4HCl(g)![]() SiCl4(g)+2H2(g) △H1=-241 kJ·mol-1
SiCl4(g)+2H2(g) △H1=-241 kJ·mol-1
②Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g) △H2= -210 kJ·mol-1
SiHCl3(g)+H2(g) △H2= -210 kJ·mol-1
③3SiCl4(g)+2H2(g)+Si(s)![]() 4SiHCl3(g) △H3= -akJ·mol-1
4SiHCl3(g) △H3= -akJ·mol-1
a=__________。
(2)工业上,利用蒸馏水吸收尾气中的氯化氢制盐酸。常用沉淀滴定法测定盐酸的浓度:取一定体积的盐酸用标准AgNO3溶液滴定,用K2CrO4溶液作指示剂。已知:298 K时Ksp(AgCl)、Ksp(Ag2CrO4)分别为 1.8×10-10、l.0×10-12。
若选择K2CrO4为指示剂,使溶液中c(CrO42-)=0.01 mol·L-1。当产生黄色Ag2CrO4沉淀时,c(Cl-)=__________ mol·L-1。
(3)研究反应③最适合的反应温度,四氯化硅的转化率随温度的变化曲线如图所示。

①图像中表示SiHCl3(g)的正反应速率小于SiHCl3(g)的逆反应速率的点是__________(填“A”“B”或“C”)。
②温度低于500℃时,随着温度升高,四氯化硅的转化率增大,其原因是_________________。
(4)一定温度下,向2L恒容密闭器中充入一定量的SiCl4(g)、H2(g)和Si(s)发生反应③,经过tmin达到平衡。测得平衡体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1 mol·L-1。
(i)从反应开始到平衡时SiCl4的平均速率为__________。
(ii)在该条件下,H2的平衡转化率为__________。升髙温度,该反应的平衡常数__________(填“增大”,“减小”或“不变”)。
(iii)若平衡后再向容器中充入与起始时等量的SiCl4(g)和H2(g)(假设硅足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将__________ (填“增大”“减小”或“不变”)。
(iv)若平衡后,将容器的体积压缩至1L(硅足量),再次达到平衡时,H2的物质的量浓度范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiA1H4常用作有机合成中的还原剂。四氢铝锂的一种合成原理是:氢化锂和氯化铝在乙醚中发生反应4LiH+AlCl3 ![]() LiAlH4+3LiCl。某学习小组拟制备氢化锂。已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。供选择的装置如图:
LiAlH4+3LiCl。某学习小组拟制备氢化锂。已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。供选择的装置如图:

(1)装置连接顺序是A、__________。C装置的作用是__________。
(2)添加药品:用镊子从试剂瓶中取出一定量的锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是_____________________,然后快速把锂放入到石英管中。
(3)实验开始时,A中反应较慢,在盐酸中滴几滴CuSO4溶液,产生H2的速率加快,其原理是__________________________________________。
(4)为了避免生成Li2O等杂质,加热石英管之前必须进行的操作是___________________。
(5)加热一段时间后停止加热,继续通入氢气冷却,然后取出氢化锂,装入氮封的瓶里,保存于暗处。采取上述操作的目的是避免氢化锂与空气中的水蒸气接触而发生危险(发生的反应为 LiH+H2O=LiOH+H2↑)。由此类比,氢化锂与乙醇反应的化学方程式为_________________。
(6)为了探究产品中是否含锂(不考虑其他杂质),进行如下实验:取mg产品在一定条件下足量的水反应,经干燥,收集到VLH2 (折合成标准状况)。若产品中不含锂,则V=__________。若产品中混有锂,则V的取值范围为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3-B.SO2C.Fe2+D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是

A. 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
B. 用图2所示装置蒸发掉CuCl2溶液中大部分水制得CuCl2·2H2O晶体
C. 用图3所示装置从乙酸和乙酸乙酯的混合液中分离得到纯净的乙酸乙酯
D. 用图4所示装置,用块状大理石与稀盐酸反应制取CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究:1-氯丙烷与NaOH乙醇溶液的反应
学习小组在进行1-氯丙烷与NaOH乙醇溶液溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体。在表中的方框中写出装置中所盛试剂的名称(试剂任选) 和实验现象。
图序 | 装置图 | 所盛试剂 | 实验现象 |
1 |
| A是_________ B是_________ | _________ |
2 |
| C是_______________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用CuSO4溶液,进行以下实验探究。
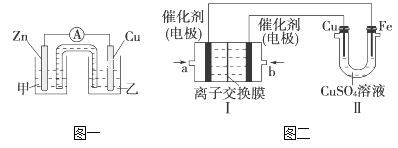
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com