
| A.H、Li、Na、K | B.I、Br、Cl、F |
| C.Na、Mg、Al、Si | D.Si、Al、Mg、Na |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源:不详 题型:单选题
| A.元素最高价氧化物的水化物的碱性强弱 |
| B.元素氧化物的水化物的酸性强弱 |
| C.元素单质跟酸反应置换出氢的难易 |
| D.元素的单质跟氢气生成气态氢化物的难易 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg、Al元素最高化合价依次升高 |
| B.N、O、F元素属于同一周期 |
| C.F、Cl、Br都属于短周期元素 |
| D.H、Li、Na原子的电子层数依次增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
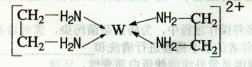
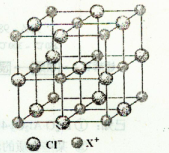
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
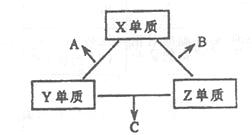
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | | | | | ① | | ② | |
| 三 | ③ | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
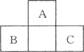
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12-3n | B.3n-12 | C.3n-10 | D.6-3n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com