
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | “血液透析”的原理利用了胶体的性质 | |
| C. | 食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮 | |
| D. | 煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾. |
分析 A.根据明矾、漂白粉、臭氧的净水原理分析;
B.血液是胶体;
C.硅胶具有吸水性,铁粉具有还原性;
D.煤炭燃烧、机动车尾气、建筑扬尘能够产生大量灰尘颗粒.
解答 解:A.明矾、硫酸铝和硫酸铁能最终水解生成胶体,胶体具有吸附性,能吸附水中的悬浮物而用来净水,漂白粉、臭氧能够使蛋白质变性,能够杀菌消毒,不能净水,所以二者原理不同,故A错误;
B.血液是胶体,胶粒不能透过半透膜,故B正确;
C.硅胶具有吸水性,铁粉具有还原性,所以食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质,故C错误;
D.煤炭燃烧、机动车尾气、建筑扬尘能够产生大量灰尘颗粒,可加重雾霾,故D正确;
故选:AC.
点评 本题考查了环境污染与治理、胶体的性质、明矾净水原理,题目难度不大,注意次氯酸钙、臭氧只能杀菌消毒,不能净水,题目难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 180Hf转化为185Hf是化学变化 | |
| B. | 二者的核外电子数分别为108、113 | |
| C. | 1mol 180Hf的中子数比1mol 185Hf少5NA | |
| D. | 在元素周期表中的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中生成1 mol Cl2,转移电子2 mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少 | |
| B. | 它们分别与足量CaCO3反应时,放出的CO2一样多 | |
| C. | 两种溶液的n(Cl-)=n(CH3COO-)相同 | |
| D. | 分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
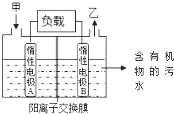 一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )
一种处理污水的燃料电池模型如图所示.该电池工作时,只需把污水注入反应池,细菌就可将污水中的有机物分解,在此过程中释放出电子、质子和乙.下列叙述不正确的是( )| A. | B电极为正极 | |
| B. | 气体乙可能为CO2 | |
| C. | O2在A电极得电子 | |
| D. | 电池工作时,B电极附近的pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | |
| B. | 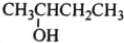 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
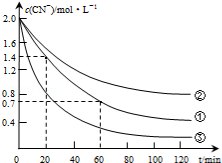 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com