
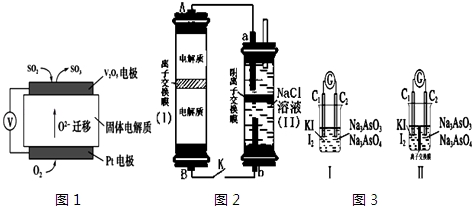
分析 (1)①原电池中阴离子移向负极;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3;
(2)①原电池的负极发生氧化反应;
②电解氯化钠溶液生成NaOH、氯气和氢气,氯气与氢氧化钠反应生成次氯酸钠和氯化钠;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电;
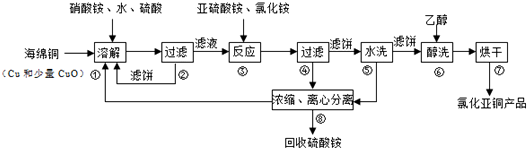
(3)①甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸,发生氧化还原反应,不发生原电池反应;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e-═2I-,为正极反应,而B中As化合价升高,发生氧化反应,以此分析.
解答 解:(1)①原电池中阴离子移向负极,故答案为:负;
②在V2O5电极上,SO2失电子发生氧化反应生成SO3,电极方程式为:SO2-2e-+O2-=SO3,故答案为:SO2-2e-+O2-=SO3;
(2)①原电池的负极发生氧化反应,所含元素化合价升高,所以负极区电解质为:Na2S2、Na2S4,故答案为:Na2S2、Na2S4;
②电解氯化钠溶液生成NaOH、氯气和氢气,氯气与氢氧化钠反应生成次氯酸钠和氯化钠,总反应的离子方程式为Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑,故答案为:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ClO-+H2↑;
③a极生成氯气,b极生成氢气,当有0.04mol Na+通过离子交换膜时,有0.04mol氢离子放电,生成氢气0.02mol,标准状况下体积为:0.02mol×22.4L/mol=0.448L=448mL,故答案为:448;
(3)①甲组操作时,两个电极均为碳棒,不发生原电池反应,则微安表(G)指针不发生偏转,故答案为:氧化还原反应在电解质溶液中直接进行,没有电子沿导线通过;
②乙组向图ⅡB烧杯中逐滴加入适量浓盐酸或40%NaOH溶液,发生原电池反应,A中发生I2+2e-═2I-,为正极反应,而B中As化合价升高,发生氧化反应,添加了阳离子交换膜,故答案为:阳.
点评 本题考查了原电池电解池相关知识以及电极反应式书写和电解计算,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
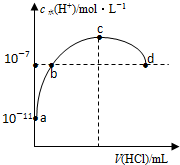
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大量共存 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 室温下,用pH试纸分别测定浓度为0.1mol•L-1NaClO溶液和0.1mol/LCH3COONa溶液的pH | pH试纸都变成碱色 | 可以用pH试纸的颜色与标准比色卡比较,从而判断HClO和CH3COOH的酸性强弱 |
| D | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量Na2S溶液 | 开始有白色沉淀生成,后有黑色沉淀生成 | Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com