
【题目】把镁条投入到盛有盐酸的敞口容器里,产生H2的速率如图所示。在下列因素中,能影响此反应速率的因素是( )

①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.①④B.②③C.①②③D.③④
【答案】C
【解析】
图中生成氢气的反应速率先增大后减小,发生的反应为:Mg+2H+═Mg2++H2↑,
①开始盐酸的浓度较大,反应速率较快,但反应后期温度较高而反应速率逐渐变小,说明反应物的浓度减小,反应速率减小,说明浓度对反应速率有影响,故①符合题意;
②由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故②符合题意;
③开始反应时浓度最大、随着反应的进行,浓度逐渐减小,如果不考虑气其它因素,反应速率应逐渐减小,但开始阶段反应速率逐渐增大,因该反应为放热反应,放热使温度升高,则反应速率加快,说明温度对反应速率有影响,故③符合题意;
④因Cl-不参加反应,Cl-的浓度增大或减小都不影响化学反应速率,且该反应中Cl-的浓度不变,故④不符合题意;
即影响反应速率的因素为①②③,故选C。


科目:高中化学 来源: 题型:
【题目】在恒温(500K)、体积为2.0L的密闭容器中通入1.0molN2和1molH2发生合成氨反应,20min后达到平衡,测得反应放出的热量为18.4kJ,混合气体的总物质的量为1.6mol。
(1)从开始反应至达到平衡时,用NH3表示该反应的化学反应速率v(NH3)=______。
(2)该反应的热化学方程式为______。
(3)若拆开1molH—H键和1molN![]() N键需要的能量分别是436kJ和946kJ,则拆开1molN—H键需要的能量是______kJ。
N键需要的能量分别是436kJ和946kJ,则拆开1molN—H键需要的能量是______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
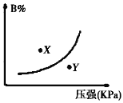
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是____________(元素符号作答),当生成标准状况下35.84 L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为10 L的反应室,CH4的平衡转化率与温度、压强的关系如图所示。

①若达到A点所需的时间为5 min,则v(H2)=____________________。
②图中的p1______p2(填“<”“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是_______。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,下列措施中能使
CO2(g)+H2(g) ΔH<0,下列措施中能使![]() 增大的是________(选填编号)。
增大的是________(选填编号)。
A.降低温度 B.恒温恒容下充入He(g)
C.将H2从体系中分离 D.再通入一定量的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com