
 与
与 ④O2和O3 ⑤氯水和氯气
④O2和O3 ⑤氯水和氯气 与
与 组成与结构相同,为同种物质;
组成与结构相同,为同种物质;

科目:高中化学 来源: 题型:
 某生物燃料电池结构示意图如图所示.请回答下列问题:
某生物燃料电池结构示意图如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
容器 |
甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
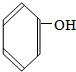 ②
②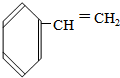 ③
③ ④
④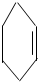 ⑤
⑤ ⑥
⑥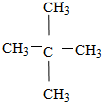
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com