
����Ŀ��������ⷨ���Ѱ۲����ķ�Һ��������(Fe2O3)�Ͳ�Ѫ������������������ҵ��������ͼ��ʾ:
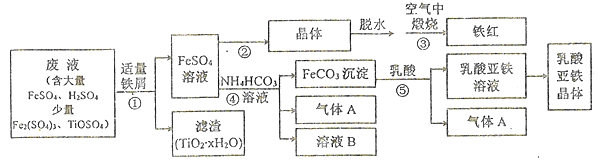
��֪;TiOSO4�ڴ���ˮ�м��������¿���ȫˮ���ΪTiO2��xH2O������
�밴Ҫ��ش���������:
��1������ټ���������м��Ŀ����_________��TiOSO4��ȫˮ��Ļ�ѧ����ʽΪ_________��
��2������ڵ�ϵ�в����У���Ҫ����__________��_________�����£��ٽ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ϴ��Һѡ��ϡ�������ˮ���ŵ���__________��
��3��д���������Ļ�ѧ����ʽ: _________��
��4��ij��ȤС��ѧ������м��ϡ���ᡢNH4HCO3��ҺΪԭ�ϣ�������ͼװ�ã����ò���ܷ�Ӧ���ﵽ�Ʊ�FeCO3��Ŀ�ġ�
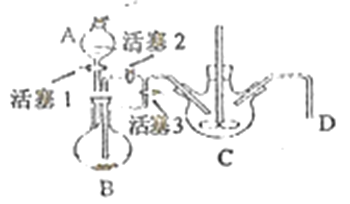
i.NH4HCO3��ҺӦʢ����װ��(����ĸ) _______�С���װ�����漰����Ҫ��Ӧ�����ӷ���ʽ_________��
ii.��ɲ���ܷ�Ӧ�IJ�����__________��
��5���ⶨ����������þ�����FeSO4��7H2O����������:
��ȡag������Ʒ�����100.00mL��Һ��ȡ��25.00mL��Һ���������ữ��0.1000mol/LKMnO4����Һ�ζ�(���ʲ���KMnO4��Һ��Ӧ)��ƽ����Чʵ��ζ�����KMnO4��Һ�����ƽ��ֵΪ20.00mL�������þ�����FeSO4��7H2O����������Ϊ����M(FeSO4��7H2O)=bg/mol���ú�a��b�ı���ʽ��ʾ��_________��
���𰸡� ��Fe3+��ԭΪFe2+,���IJ���H+ TiOSO4+(x+1)H2O(����) ![]() TiO2��xH2O��+H2SO4 ������Χ�����۹��� ������� ���پ�����ܽ⣬��߲��� 4FeSO4+O2
TiO2��xH2O��+H2SO4 ������Χ�����۹��� ������� ���پ�����ܽ⣬��߲��� 4FeSO4+O2![]() 2Fe2O3+4SO3 C Fe2++2HCO3-=FeCO3��+H2O+CO2�� ������D���ܵ��������崿���رջ���3,����2 (0.04b/a)x100%
2Fe2O3+4SO3 C Fe2++2HCO3-=FeCO3��+H2O+CO2�� ������D���ܵ��������崿���رջ���3,����2 (0.04b/a)x100%
����������1����ʵ��Ŀ��֪Ҫ�����������͵ð�Fe3+��ԭΪFe2������ټ���������м��Ŀ���ǽ�Fe3+��ԭΪFe2+,ͬʱ�������Ժ��ᷴӦ���IJ���H+��TiOSO4��ȫˮ������TiO2��xH2O��H2SO4���仯ѧ����ʽΪTiOSO4+(x+1)H2O(����) ![]() TiO2��xH2O��+H2SO4��
TiO2��xH2O��+H2SO4��
��2��Ϊ�˷�ֹ�ڼ��ȹ�����Fe2+��������ˮ�⣬���Բ���ڲ�������Ҫ�����ڵ�����Χ�����۹�������������������½�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ϴ��Һѡ��ϡ�������ˮ���ŵ��м��پ�����ܽ⣬��߲��ʡ�
��3�������������ɵĵ�FeSO4����������������ķ�Ӧ���䷴Ӧ�Ļ�ѧ����ʽ: 4FeSO4+O2![]() 2Fe2O3+4SO3��
2Fe2O3+4SO3��
i����ܷ�Ӧ��FeSO4��NH4HCO3��Ӧ��ȡFeCO3������NH4HCO3��ҺӦʢ����Cװ���С���װ����Ҫ��Ӧ�����ӷ���ʽFe2++2HCO3-=FeCO3��+H2O+CO2����
ii.��Ϊ�������Ӻܲ��ȶ������ױ��������������Ҫ��ɲ���ܱ������ų�װ���еĿ��������Դ�ɲ���ܷ�Ӧ�IJ����Ǵ�����D���ܵ��������崿���رջ���3,����2������
��5���������ӻᱻ�����������Ϊ����������, KMnO4����ԭΪ+2�۵�������,���ݵ����غ�,��FeSO4��7H2O- KMnO4,����0.1000mol/LKMnO4��Һ20.00mL,���Ծ�����FeSO4��7H2O����������=[(0.1000mol/L![]() 0.02
0.02![]() b
b![]() )/ag]
)/ag]![]() 100%= (0.04b/a)x100%����˱�����ȷ����: (0.04b/a)x100%��
100%= (0.04b/a)x100%����˱�����ȷ����: (0.04b/a)x100%��


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͼΪ�ɱ��ľ����ṹ���۲�ͼ�Σ�ȷ���ڸɱ���ÿ��CO2������Χ��________����֮�����ҵȾ����CO2���ӡ��ڸɱ�������þ�ۣ��ú��ȵ�������ȼ���ٸ�����һ��ɱ������ֵ�����Ϊ____________________________����Ӧ�Ļ�ѧ����ʽ��__________________��
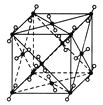
(2)�������־����CO2����CS2����SiO2���۵��ɸߵ��͵�˳����________>________>________(��������)����ԭ����___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���4molA��3molB�������Ϊ1L���ܱ������У��������·�Ӧ��aA(g)+2B(g)![]() 3C(g)+D(g)����Ӧ�ﵽƽ���C��Ũ��Ϊ3mol/L��ѹ�����������ʹ�����������Сһ�룬�����µ�ƽ��ʱ��B��Ũ��Ϊ2mol/L����ʽ��a����ֵΪ
3C(g)+D(g)����Ӧ�ﵽƽ���C��Ũ��Ϊ3mol/L��ѹ�����������ʹ�����������Сһ�룬�����µ�ƽ��ʱ��B��Ũ��Ϊ2mol/L����ʽ��a����ֵΪ
A. 1 B. 2 C. 3 D. 4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���״�(CH3OH)����Ҫ���ܼ������ȼ�ϣ���ҵ����CO��H2��һ���������Ʊ�CH3OH�ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼһ��ʾ��
CH3OH(g)�������Ϊ1L�ĺ����ܱ������У�����2molCO��4molH2��һ�������·���������Ӧ�����CO(g)��CH3OH(g)��Ũ����ʱ��仯��ͼһ��ʾ��
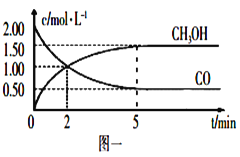
�ٴӷ�Ӧ��ʼ��5min����CO��ʾ��ƽ����Ӧ����v(CO)=________��
������˵����ȷ����____________(����ĸ���)��
A���ﵽƽ��ʱ��H2��ת����Ϊ65%
B��5min�������л�������ƽ����Է����������ٸı�
C���ﵽƽ����ٳ����������Ӧ���ʼ�С
D��2minǰv(��)>v(��)��2min��v(��)<v(��)
��2��̼��ˮ������Ӧ��ȡH2����ط�Ӧ���£�
����C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.0kJ/mol
����CO(g)+H2O(g)=CO2(g)+H2(g) ��H= - 43kJ/mol
����CaO(s)+CO2(g)=CaCO3(S) ��H= - 178.3kJ/mol
�ټ��㷴Ӧ��C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)�ġ�H=_______kJ/mol��
CaCO3(s)+2H2(g)�ġ�H=_______kJ/mol��
��K1��K2��K3�ֱ�Ϊ��Ӧ������������ƽ�ⳣ������Ӧ��ƽ�ⳣ��K=__________(��K1��K2��K3��ʾ)��
�ڶ��ڿ��淴ӦC(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g)����ȡ���´�ʩ�������H2���ʵ���________��(����ĸ)
CaCO3(s)+2H2(g)����ȡ���´�ʩ�������H2���ʵ���________��(����ĸ)
A��������ϵ���¶� B��ѹ����������� C������CaO���� D��ѡ���ʵ��Ĵ���
��3�����ڿ��淴ӦC(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g)���÷�Ӧ_______�����������������������Է����С�
CaCO3(s)+2H2(g)���÷�Ӧ_______�����������������������Է����С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6mol/L�����ᣬ�����Լ���ѡ������������⣺
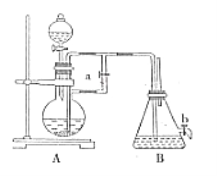
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���_______________��A�з�����Ӧ��Ŀ����_____________________________��
��2��ʵ�鿪ʼʱӦ�Ƚ����ɼ�a________(�������������ر���)��
��3��װ��B������Fe(OH)2�IJ������۲쵽������Ϊ_______________��
��4��ʵ����ϣ���b�����ɼУ�����һ���ֿ�������ʱB�з����ķ�ӦΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������һ�ּ�ǿ�����������Ȼ��������������ᣨͼ1�����������һ��pH�·�Ӧ���Ʊ������������ᣨͼ2������ԭ����ȫ��Ӧ���������������ᣬ����˵����ȷ����
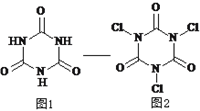
A. ������ķ���ʽΪC6N3O3H3
B. HClO�ĵ���ʽΪ ![]()
C. ��ת�������л������ԭ��Ӧ
D. ������ʹ����ᷴӦ�����ʵ���֮��Ϊ2 : 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
�ٵ����ǽ���ѧ��ת��Ϊ���ܵ�װ��
��ԭ����ǽ�����ת��ɻ�ѧ�ܵ�װ��
�۲����Է����е�������ԭ��Ӧ,ͨ������ԭ���п���ʵ��
�ܵ�ƹ����൱�ڽ�������Ǩ����������Ϊ�����仯
A. ��B. �ۢ�C. �ڢۢ�D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1mol O2�ڷŵ������·������з�Ӧ��3O2![]() 2O3������30%O2ת��ΪO3����ŵ���������H2������ܶ���( )
2O3������30%O2ת��ΪO3����ŵ���������H2������ܶ���( )
A. 16 B. 17.8 C. 18.4 D. 35.6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ָ����Һ�п��Դ����������
A. pH=11����Һ�У�CO32-��Na+��AlO2-��NO3-
B. ����Al�ų�H2����Һ�У�SO42-��NH4+��Na+��F-
C. pH=7����Һ�У�SO32-��Na+��K+��ClO��
D. ��ɫ��Һ�У�K+��SO42-��Cu2+��Cl��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com