
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁在一定条件下,可与水蒸气反应写出该反应的化学方程式______________________________
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,作用是消除焊接处的铁锈(成分是Fe2O3)。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中有4 mol的Fe2O3参与反应能________ (填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为_____。
(4)高铁酸钠Na2FeO4是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.[KAl(SO4)2·12H2O] B.Al(OH)3 胶体
C.ClO2 D.“84”消毒液
【答案】![]() Fe3++3H2O
Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ 6NH4Cl+4Fe2O3===6Fe+2FeCl3+3N2↑+12H2O NH4Cl 得到 18 80 g NaCl AB
Fe(OH)3(胶体)+3H+ 6NH4Cl+4Fe2O3===6Fe+2FeCl3+3N2↑+12H2O NH4Cl 得到 18 80 g NaCl AB
【解析】
(1)铁在高温下与水蒸气反应的化学方程式为![]() 。
。
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,这时发生Fe3+的水解反应,产生氢氧化铁胶体和盐酸。
(3)①根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,用化合价升降法配平方程式。
②NH4Cl中N元素的化合价由-3价升高到0,所以NH4Cl发生氧化反应。
③气体与起氧化剂作用的氧化铁的关系为,3N2~3Fe2O3。
(4)①因为反应前后各元素原子个数相等,X的化学式为NaCl。
②氢氧化铝胶体能够吸附水中的悬浮物。
(1)铁在高温下与水蒸气反应的化学方程式为![]() ,故答案为:
,故答案为:![]() 。
。
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,这时发生Fe3+的水解反应,产生氢氧化铁胶体和盐酸,离子方程式为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,故答案为:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(3)①根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,
由反应物和生成物可知, NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,根据电子守恒、结合N和Cl守恒可知,得电子数=失电子数=18e-,6NH4C1+Fe2O3→6Fe+2FeC13+3N2↑+H2O,再根据原子守恒可知,配平的化学反应为6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O ,故答案为:6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O。
②NH4Cl中N元素的化合价由-3价升高到0,所以NH4Cl发生氧化反应,Fe元素的化合价由+3价降低为0,但在6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O中,4molFe2O3参与反应只生成6mol Fe,故得到18mol电子,故答案为:得到;18。
③11.2 L(标准状况)的气体的物质的量为0.5mol,被还原的物质是Fe2O3,气体与起氧化剂作用的氧化铁的关系为,3N2~3Fe2O3,则被还原的物质的质量为0.5mol×160g/mol=80g,故答案为:80g。
(4)①因为反应前后各元素原子个数相等,X的化学式为NaCl,故答案为:NaCl。
②A.[KAl(SO4)2·12H2O] 电离生成的铝离子水解生成氢氧化铝胶体能够吸附水中的悬浮物,故A正确;
B .Al(OH)3 胶体,能够吸附水中的悬浮物,故B正确;
C.二氧化氯具有强氧化性,可以消毒杀菌,故C错误;
D.“84”消毒液也有杀菌消毒作用,故D错误。
故选AB。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )

A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中进行,达到平衡状态的标志是
①单位时间内生成nmolO2的同时消耗2nmolNO2
②单位时间内生成nmolO2的同时消耗2nmolNO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ②④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
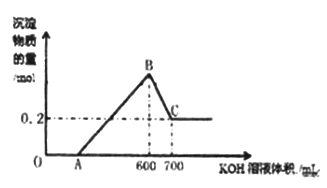
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐、氧化物顺序分类正确的是( )
A.硫酸、纯碱、石膏、铁红
B.醋酸、烧碱、纯碱、生石灰
C.碳酸、熟石膏、小苏打、三氧化硫
D.氯化氢、苛性钠、氯化钠、石灰石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某兴趣小组用下图装置在通风橱中进行如下实验:
实验 | 现象 |
| 试管中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色. |
试管中剧烈反应,迅速生成大量红棕色气体, 溶液呈绿色;之后向绿色溶液中持续通入N2, 溶液变为蓝色. |
下列说法正确的是
A. 试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B. 等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多
C. 换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D. 试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com